16 bài tập trắc nghiệm Ôn tập Hóa học 12 Học kì 1 (có đáp án)
Với 16 bài tập & câu hỏi trắc nghiệm Ôn tập Hóa học 12 Học kì 1 lớp 12 có đáp án và lời giải chi tiết đầy đủ các mức độ nhận biết, thông hiểu, vận dụng sẽ giúp học sinh ôn luyện trắc nghiệm Hóa học 12.
16 bài tập trắc nghiệm Ôn tập Hóa học 12 Học kì 1 (có đáp án)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
A. Hóa học vô cơ
Câu 1: Trong các yếu tố sau:
(a) Bán kính nguyên tử
(b) Số electron tự do
(c) Cấu trúc mạng tinh thể
Các yếu tố ảnh hưởng đến tính chất vật lí của kim loại là:
A. (a) và (b) B. (b) và (c)
C. (a) và (c) D. (a), (b) và (c)
Đáp án: D
Câu 2: Cho các phản ứng sau:
(a) X+ + Y2+ → X + Y3+
(b) 3Y3+ + Z → Z3+ + 3Y2+
(c) 3Y + 2Z3+ → 3Y2+ + 2Z
Trong đó X, Y, Z là các kim loại
Căn cứ vào các phản ứng trên có thể suy ra kết luận nào sau đây?
A. Tính oxi hóa X+ > Y2+ > Z3+
B. Tính oxi hóa Y3+ > Y2+ > Z3+
C. Tính khử Z > Y > X
D. Tính khử Z > Y2+ > X
Đáp án: D
Từ các phản ứng ta suy ra suy ra thứ tự các cặp oxi hoá khử như sau:
Y2+/Y; Z3+/Z; X+/X
Từ trái sang phải tính oxi hoá tăng dần, tính khử giảm dần
Câu 3: Cho lá kẽm lần lượt vào từng dung dịch muối tan sau: CuSO4, AlCl3, Pb(NO3)2, Mg(NO3)2, FeCl2, FeCl3, NaNO3, AgNO3 . Sau một thời gian nhấc thanh kẽm ra cân lại. Số trường hợp khối lượng lá kẽm giảm đi là:
A. 2. B. 3 C. 4 D. 7
Đáp án: B
Kẽm tác dụng với các dung dịch CuSO4, FeCl2, FeCl3 và khối lượng bị giảm đi (do nguyên tử kẽm bị thay thế bằng nguyên tử kim loại có khối lượng nguyên tử bé hơn)
Câu 4: Cho a mol Mg vào dung dịch có chứa 0,01 mol CuSO4 và 0,01 mol FeSO4. Sau khi phản ứng kết thúc thu được dung dịch A có 2 muối. Vậy a có giá trị trong khoảng nào sau đây ?
A. 0 < a ≤ 0,01 B. 0,01 ≤ a ≤ 0,02
C. 0,01 ≤ a < 0,01 D. a ≥ 0,02
Đáp án: C
Vì sau phản ứng thu được dung dịch có 2 muối nên hai muối là MgSO4 và FeSO4
Vì trong dung dịch còn FeSO4 nên suy ra Mg đã phản ứng hoàn toàn.
Xét 2 phản ứng:
Mg + CuSO4 → MgSO4 + Cu
Mg + FeSO4 → MgSO4 + Fe
Phản ứng 1 đã xảy ra hoàn toàn ( do đã hết muối CuSO4 trong dung dịch)
Phản ứng 2 có thể chưa xảy ra hoặc FeSO4 mới chỉ phản ứng một phần ( vẫn còn FeSO4 trong dung dịch)
Vậy tổng số mol Mg phải nằm trong khoảng 0,01 ≤ a ≤ 0,02
Câu 5: Sắt tây là hợp kim của thiếc và sắt, trong đó thiếc bao phủ bên ngoài thép. Khi bề mặt bị xước sâu, có thể quan sát được hiện tượng nào sau đây ?
A. Tại vị trí xước xảy ra ăn mòn điện hóa. Kim loại sắt là cực âm, bị ăn mòn điện hoá,
B. Tại vị trí xước xảy ra ăn mòn điện hóa. Kim loại sắt là cực dương, bị ăn mòn điện hóa.
C. Do thiếc đã tạo thành lớp oxit bền nên không có hiện tượng ăn mòn kim loại.
D. Củ sắt và thiếc sẽ cùng bị ăn mòn điện hoá do cả hai cùng có khả năng tác dụng vớí oxi không khí.
Đáp án: A
Câu 6: Hoà tan hoàn toàn 37,6 gam hỗn hợp muối gồm ACO3 ; BCO3 ; R2CO3 (A, B là kim loại nhóm IIA ; R là kim loại IA) bằng dung dịch HNO3 dư, thấy thu được 8,96 lít khí ở đktc. Khối lượng muối trong dung dịch thu được là
A. 63,2 gam. B. 70,4 gam. C. 38,4 gam. D. 84,2 gam.
Đáp án: A
Xét các phản ứng với HNO3
ACO3 + 2HNO3 → A(NO3)2 + H2O + CO2
BCO3 + 2HNO3 → B(NO3)2 + H2O + CO2
R2CO3 + 2HNO3 → RNO3 + H2O + CO2
Nhận xét: trong các phản ứng trên, 1 phân tử muối cacbonat đã phản ứng với 2 phân tử HNO3 sinh ra muối, 1 phân tử H2O và 1 phân tử CO2
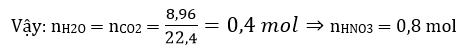
mmuốicacbonat + mHNO3= mmuốinitrat + mH2O + mCO2
hay 37,6 + 0,8.63 = mmuối nitrat + 0,4.44 + 0,4.18
Suy ra mmuốinitrat = 63,2 gam
Câu 7: Điện phân 200 ml dung dịch chứa 2 muối Cu(NO3)2 xM và AgNO3 yM với cường độ dòng đíện 0,804A, thời gian điện phân là 2 giờ, người ta thấy khối lượng catot tăng thêm 3,44 gam. Giá trị của y là:
A. 0,1. B. 0,02. C. 0,04. D. 0,05.
Đáp án: A
Số mol muối Cu(NO3)2 và AgNO3 trong dung dịch lần lượt là 0,2x và 0,2y
Điện lượng đi qua dung dịch là q = It = 0,804.2.3600 = 5788,4 (C)
Giả sử tại catot chỉ có Ag+ bị điện phân. Vậy : nAg+ = 0,06 mol
Khi đó: khối lượng Ag kết tủa trên catot là: 0,06.108 = 6,48 gam > 3,44 gam
Như vậy: lượng Ag+ thực tế bị điện phân ít hơn. Tức là điện lượng đi qua dung dịch phải điện phân cả Ag+ và Cu2+.
Các quá trình xảy ra: Ag+ +1e → Ag
Cu2+ + 2e → Cu
Gọi số mol Cu2+ bị điện phân là a
Theo đề ta có:
Tổng khối lượng kim loại tạo ra ở catot: 108.0,2y + 64a = 3,44 (1)
Điện lượng đi qua bình điện phân : (0,2x + a).F = 5788,8 (2)
Giải hệ (1) và (2) suy ra: y = 0,2 và x = 0,02
Câu 8: Cho 5,05 gam hỗn hợp gồm kali và một kim loại kiềm khác tác dụng hết với nước. Để trung hoà hoàn toàn dung dịch thu được cần dùng hết 250 ml dung dịch H2SO4 0,3M. Biết rằng tỉ lệ về số mol của kim loại kiềm chưa biết và kali trong hỗn hợp lớn hơn “. Phần trăm khối lượng kali trong hỗn hợp là :
A, 22,6%. B. 38,6%. C. 77,2%. D. 96,5%.
Đáp án: C
Đặt công thức chung của hỗn hợp là M
Các phản ứng xảy ra: (1) M + H2O → M+ + OH- + 1/2 H2
(2) OH- + H+ → H2O
Theo phản ứng (2) ta có: nOH- = nH+ = 0,25.0,3.2 = 0,15 mol
Theo phản ứng (1) ta có: nOH- = nM = 0,15 mol
Khối lượng trung bình của hai kim loại kiềm là
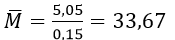
Vì MK = 39 > 33,67 nên kim loại kiềm còn lại có khối lượng phân tử nhỏ hơn 33,67
Gọi khối lượng phân tử kim loại kiềm chưa biết là X. Gọi x và y lần lượt là số mol X và K. Ta lập sơ đồ đường chéo:
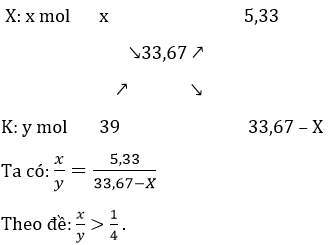
Từ đó suy ra: X > 12,35. Vậy X là kim loại Na
Ta có hệ:
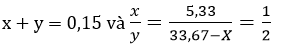
Giải hệ gồm 2 phương trình trên ta được x = 0,05 và y = 0,1
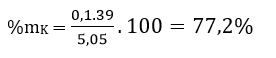
B. Hóa học hữu cơ
Câu 9: Thủy phân hoàn toàn hỗn hợp metyl axetat và etyl axetat trong dung dịch NaOH đun nóng vừa đủ. Sau phản ứng thu được:
A. 1 muối và 1 ancol B 1 muối và 2 ancol
C. 2 muối và 1 ancol, D. 2 muối và 2 ancol.
Đáp án: B
Câu 10: Cho dãy các chất glucozo, fructozo, saccarozo, tinh bột, xenlulozơ. Số chấttrong dãy có khả năng tham gia phản ứng thủy phân trong môi trường axit là :
A. 2 B. 3. C. 4. D. 5.
Đáp án: B
Câu 11: Cho dãy các chất : C6H5OH (phenol), C6H5NH2 (anilin), H2NCH2COOH, CH3CH2COOH, CH3CH2CH2NH2. Số chất trong dãy tác dụng được với dung dịch HCl là:
A. 2. B. 5. C. 3. D. 4.
Đáp án: C
Câu 12: Polime nào sau đây được dùng làm chất dẻo ?
A. Poli(metyl metacrylat). B. Poli (hexametylen ađipamit)
C. Poliacrilonitrin D. Polibuta-l,3-đien
Đáp án: A
Câu 13: Khi lên men 360 gam glucozo thành ancol etylic với hiệu suất 50%, khối lượng ancol etylic thu được là:
A. 184 gam. B. 92 gam. C. 368 gam. D. 46 gam.
Đáp án: B
C6H12O6 → 2C2H5OH + 2CO2
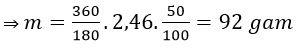
Câu 14: Hỗn hợp X gồm 1 mol amino axit no, mạch hở và 1 mol amin no, mạch hở. X có khả năng phản ứng tối đa với 2 mol HCl hoặc 2 mol NaOH. Đốt cháy hoàn toàn X thu được 6 mol CO2, X mol H2O và y mol N2. Các giá trị X, y tương ứng là
A. 7 và 1,5. B. 8 và 1,0. C. 7 và 1,0. D. 8 và 1,5.
Đáp án: C
X + 2 mol HCl ⇒ amin và amino axit đều có 1 nhóm NH2
X + 2 mol NaOH ⇒ amino axit có 2 nhóm COOH
⇒ amin: CnH2n+3N: amino axit: CmH2m-1O4N
⇒ nH2O – nCO2 = 1,5namin – 0,5namino axit ⇒ nH2O = 6+ 1,5.1 – 0,5.1 = 7,0
Bảo toàn N: 2nN2 = namin + namino axit ⇒ nN2 = 1 mol
Câu 15: Thủy phân hết một lượng tripeptit Ala-Gly-Ala (mạch hở), thu được hỗn hợp gồm 97,9 gam Ala ; 22,5 gam Gly ; 29,2 gam Ala-Gly và m gam Gly-Ala. Giá trị của m là
A.49,2. B.43,8. C. 39,6. D. 48,0.
Đáp án: B
nAla = 1,1 mol; nGly = 0,3 mol; nAla-Gly = 0,2 mol; nGly-Ala = x mol
Ala-Gly-Ala có Ala: Gly= 2:1 ⇒ 1,1 + 0,2 + x = 2.(0,3 + 0,2 + x)
⇒ x = 0,3 mol ⇒ m = 0,3.146 = 43,8 gam
Câu 16: Đốt cháy hoàn toàn 0,33 mol hổn hợp X gồm metyl propionat, metyl axetat và 2 hiđrocacbon mạch hở cần vừa đủ 1,27 mol O2, tạo ra 14,4 gam H2O. Nếu cho 0,33 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là
A. 0,26. B. 0,30. C. 0,33. D. 0,40.
Đáp án: D
Hỗn hợp X gồm este no đơn chức và hidrocacbon nên;
nBr2 = nCO2 – nH2O
bảo toàn nguyên tố O: 2nX + 2nO2 = 2nCO2 + nH2O
⇒ 2. 0,03 + 2. 1,27 = 2nCO2 + 0,8
⇒ nCO2 = 1,2 mol
nBr2 = 1,2 – 0,5 = 0, 7 mol
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Bài tập & Câu hỏi trắc nghiệm Hóa học 12 có đáp án khác:
- Đề thi Học kì 1 Hóa học 12 (có đáp án)
- 15 bài tập trắc nghiệm Kim loại kiềm, kim loại kiềm thổ, nhôm (có đáp án)
- 15 bài tập trắc nghiệm Kim loại kiềm thổ (có đáp án)
- 15 bài tập trắc nghiệm Nhôm (Al) (có đáp án)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

