Hóa 10 Bài 30: Lưu huỳnh
Hóa 10 Bài 30: Lưu huỳnh
Video Giải bài tập Hóa 10 Bài 30: Lưu huỳnh - Cô Phạm Thu Huyền (Giáo viên VietJack)
Bài 1 (trang 132 SGK Hóa 10 - Video giải tại 19:30): Lưu huỳnh tác dụng với aixt sunfuric đặc, nóng:
S + 2H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Chọn đáp án đúng.
Lời giải:
D đúng.
S là chất khử (chất bị oxi hóa) ⇒ Số nguyên tử S bị oxi hóa là 1
H2SO4 là chất oxi hóa (chất bị khử) ⇒ Số nguyên tử S bị khử là 2
⇒ tỉ lệ số nguyên tử S bị khử: số nguyên tử S bị oxi hóa là: 2:1
Bài 2 (trang 132 SGK Hóa 10 - Video giải tại 23:32): Dãy đơn chất nào sau đây vừa có tính oxi hóa vừa có tính khử?
A. Cl2 , O3, S.
B. S, Cl2, Br2.
C. Na, F2, S.
D. Br2, O2, Ca.
Lời giải:
B đúng.
Bài 3 (trang 132 SGK Hóa 10 - Video giải tại 26:08): Có thể dự đoán sự thay đổi như thế nào về khối lượng riêng, về nhiệt độ nóng chảy khi giữ lưu huỳnh đơn tà (SB ) dài ngày ở nhiệt độ phòng?
Lời giải:
Ở nhiệt độ phòng, có sự chuyển hóa từ Sβ → Sα vậy khi giữ Sβ vài ngày ở nhiệt độ phòng thì:
- Khối lượng riêng của lưu huỳnh tăng dần.
- Nhiệt độ nóng chảy của lưu huỳnh giảm dần.
Bài 4 (trang 132 SGK Hóa 10 - Video giải tại 29:34): Đun nóng một hỗn hợp gồm có 0,650g bột kẽm và 0,224g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng, người ta thu được chất nào trong ống nghiệm? Khối lượng là bao nhiêu?
Lời giải:
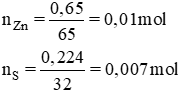
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S 
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
Bài 5 (trang 132 SGK Hóa 10 - Video giải tại 34:56): 1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
a) Viết các phương trình hóa học của phản ứng xảy ra.
b) Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo:
- lượng chất.
- khối lượng chất.
Lời giải:
a) Phương trình hóa học của phản ứng
Fe + S → FeS
2Al + 3S → Al2S3
b) Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 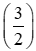
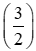
⇒ nS = x + 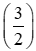
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
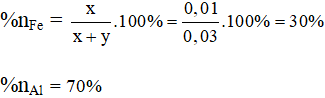
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 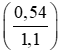
%mFe = 100% - 49,09% = 50,91%
Xem thêm các bài Giải bài tập Hóa học 10 (có video) hay khác:
- Bài 29: Oxi - Ozon
- Bài 31: Bài thực hành số 4. Tính chất của oxi, lưu huỳnh
- Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- Bài 33: Axit sunfuric - Muối sunfat
- Bài 34: Luyện tập: Oxi và lưu huỳnh
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

