Giải Hóa học 10 trang 30 Cánh diều
Với Giải Hóa học 10 trang 30 trong Bài 5: Lớp, phân lớp và cấu hình electron Hóa học 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 30.
Giải Hóa học 10 trang 30 Cánh diều
Luyện tập 4 trang 30 Hóa học 10: Dự đoán tính chất hóa học cơ bản (tính kim loại, tính phi kim, tính trơ) của các nguyên tố có Z từ 1 đến 20.
Lời giải:
Số hiệu nguyên tử (Z) |
Cấu hình electron |
Tính chất hóa học cơ bản |
1 |
1s1 |
Tính phi kim (H) |
2 |
1s2 |
Khí hiếm (tính trơ) (He) |
3 |
1s22s1 |
Tính kim loại |
4 |
1s22s2 |
Tính kim loại |
5 |
1s22s22p1 |
Tính phi kim (B) |
6 |
1s22s22p2 |
Tính phi kim |
7 |
1s22s22p3 |
Tính phi kim |
8 |
1s22s22p4 |
Tính phi kim |
9 |
1s22s22p5 |
Tính phi kim |
10 |
1s22s22p6 |
Khí hiếm (tính trơ) |
11 |
1s22s22p63s1 |
Tính kim loại |
12 |
1s22s22p63s2 |
Tính kim loại |
13 |
1s22s22p63s23p1 |
Tính kim loại |
14 |
1s22s22p63s23p2 |
Tính phi kim |
15 |
1s22s22p63s23p3 |
Tính phi kim |
16 |
1s22s22p63s23p4 |
Tính phi kim |
17 |
1s22s22p63s23p5 |
Tính phi kim |
18 |
1s22s22p63s23p6 |
Khí hiếm (Tính trơ) |
19 |
1s22s22p63s23p64s1 |
Tính kim loại |
20 |
1s22s22p63s23p64s2 |
Tính kim loại |
Bài 1 trang 30 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s.
(c) Trong một nguyên tử*, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần năng lượng của electron thuộc AO 2p.
(*) Ngoại trừ nguyên tử H có năng lượng các phân lớp trong một lớp là bằng nhau.
Lời giải:
(a) Sai. Các orbital s đều có dạng hình cầu.
(b) Đúng. Electron thuộc các lớp khác nhau, càng xa hạt nhân thì có năng lượng càng cao.
(c) Sai. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
(d) Đúng. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
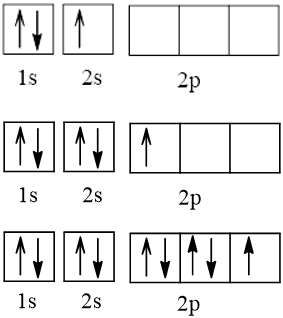
Bài 2 trang 30 Hóa học 10: Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
Lời giải:
Cấu hình electron theo orbital của nguyên tố X có thể là
Vậy X có thể là Z = 3 (Li) hoặc Z = 5 (Bo) hoặc Z = 9 (F).
Bài 3 trang 30 Hóa học 10: Cấu hình electron của các ion được thiết lập bằng cách nhận hoặc nhường electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của ion Na+ và ion Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Lời giải:
a) Cấu hình electron của Na (Z = 11): 1s22s22p63s1
Cấu hình electron của Na+ là 1s22s22p6
Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5
Cấu hình electron của Cl- là 1s22s22p63s23p6
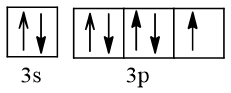
b) Cấu hình theo orbital lớp ngoài cùng của nguyên tử Cl
Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp 3p của Cl. AO đó là AO chứa 1 electron.
Lời giải bài tập Hóa học 10 Bài 5: Lớp, phân lớp và cấu hình electron hay khác:
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Hóa 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Hóa 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

