Giải Hóa học 10 trang 17 Kết nối tri thức
Với Giải Hóa học 10 trang 17 trong Bài 4: Ôn tập chương 1 Hóa học 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 17.
- Hóa học lớp 10 trang 17 Câu hỏi 1
- Hóa học lớp 10 trang 17 Câu hỏi 2
- Hóa học lớp 10 trang 17 Câu hỏi 3
- Hóa học lớp 10 trang 17 Câu hỏi 4
- Hóa học lớp 10 trang 17 Câu hỏi 5
- Hóa học lớp 10 trang 17 Câu hỏi 6
- Hóa học lớp 10 trang 17 Câu hỏi 7
- Hóa học lớp 10 trang 17 Câu hỏi 8
- Hóa học lớp 10 trang 17 Câu hỏi 9
- Hóa học lớp 10 trang 17 Câu hỏi 10
Giải Hóa học 10 trang 17 Kết nối tri thức
Câu 1 trang 27 Hóa học 10: Số proton, neutron và electron của lần lượt là
A. 19, 20, 39. B. 20, 19, 39.
C. 19, 20, 19. D. 19, 19, 20.
Lời giải:
Đáp án C
Dựa trên kí hiệu nguyên tử xác định được:
Số electron = Số proton = Z = 19
Số neutron = A – Z = 39 – 19 = 20
Câu 2 trang 27 Hóa học 10: Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
A. B.
C. D.
Lời giải:
Đáp án C
Ta có: Số electron = Z
- Cấu hình electron của Na (Z = 11) là 1s2 2s2 2p6 3s1 ⇒ Nguyên tử Na có 1 electron lớp ngoài cùng.
- Cấu hình electron của N (Z = 7) là 1s2 2s2 2p3 ⇒ Nguyên tử N có 5 electron lớp ngoài cùng.
- Cấu hình electron của Al (Z = 13) là 1s2 2s2 2p6 3s2 3p1 ⇒ Nguyên tử Al có 3 electron lớp ngoài cùng.
- Cấu hình electron của C (Z = 6) là 1s2 2s2 2p2 ⇒ Nguyên tử C có 4 electron lớp ngoài cùng.
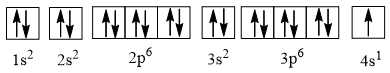
Câu 3 trang 27 Hóa học 10: Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là
A. 8 B. 9
C. 11 D. 10
Lời giải:
Đáp án D
Cấu hình electron của potassium là 1s2 2s2 2p6 3s2 3p6 4s1 có thể được biểu diễn theo ô orbital như sau:
⇒ Potassium có 10 orbital chứa electron.
Câu 4 trang 27 Hóa học 10: Nguyên tử của nguyên tố sodium (Z = 11) có cấu hình electron là
A. 1s22s22p63s2.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p53s2.
Lời giải:
Đáp án C
Số electron = Z = 11
⇒ Cấu hình electron của nguyên tử là 1s2 2s2 2p6 3s1.
Câu 5 trang 27 Hóa học 10: Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
A. Cl. B. Ca.
C. K. D. S.
Lời giải:
Đáp án C
Gọi số hạt proton, neutron và electron trong nguyên tử X lần lượt là p, n và e.
Theo bài ta có:
⇒ Theo bảng tuần hoàn, nguyên tố thuộc ô 19 là K.
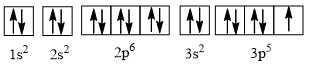
Câu 6 trang 27 Hóa học 10: Nguyên tố chlorine có Z = 17. Hãy cho biết số lớp electron, số electron thuộc lớp ngoài cùng, số electron độc thân của nguyên tử chlorine.
Lời giải:
Ta có: số electron = Z = 17
⇒ Cấu hình electron của chlorine là 1s2 2s2 2p6 3s2 3p5.
⇒ Nguyên tử chlorine có 3 lớp electron và 7 electron lớp ngoài cùng.
Cấu hình electron theo ô orbital là
⇒ Số electron độc thân bằng 1.
Câu 7 trang 27 Hóa học 10: Nguyên tử khối trung bình của vanadium (V) là 50,9975. Nguyên tố V có 2 đồng vị trong đó đồng vị chiếm 0,25%. Tính số khối của đồng vị còn lại.
Lời giải:
Giả sử đồng vị còn lại của V có dạng và chiếm 100% - 0,25% = 99,75%
=>
A = 51
Câu 8 trang 27 Hóa học 10: Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1;
- Nguyên tử Y: 1s22s22p63s23p4.
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Lời giải:
a) Nguyên tử X chứa 19 electron, nguyên tử Y chứa 16 electron.
b) Số hiệu nguyên tử Z = số proton = số electron.
⇒ Số hiệu nguyên tử của X và Y lần lượt là 19 và 16.
c) Các electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao.
⇒ Các electron ở phân lớp ngoài cùng có mức năng lượng cao nhất.
⇒ Lớp electron thứ 4 trong nguyên tử X có mức năng lượng cao nhất.
Lớp electron thứ 3 trong nguyên tử Y có mức năng lượng cao nhất.
d) Dựa vào cấu hình electron của X và Y, ta có:
- Nguyên tử X có 4 lớp electron và 6 phân lớp electron (1s, 2s, 2p, 3s, 3p, 4s).
- Nguyên tử Y có 3 lớp electron và 5 phân lớp electron (1s, 2s, 2p, 3s, 3p).
e) Nguyên tử X có 1 electron lớp ngoài cùng nên X là kim loại.
Nguyên tử Y có 6 electron lớp ngoài cùng nên Y là phi kim.
Câu 9 trang 27 Hóa học 10: Nguyên tố X được dùng để chế tạo hợp kim nhẹ, bền, dùng trong nhiều lĩnh vực: hàng không, ô tô, xây dựng, hàng tiêu dùng, .... Nguyên tố Y ở dạng , đóng vai trò quan trọng trong các phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng để vận chuyển năng lượng. Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1. Nguyên tử của nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3. Viết cấu hình electron nguyên tử của X và Y. Tính số electron trong các nguyên tử X và Y. Nguyên tố X và Y có tính kim loại hay phi kim?
Lời giải:
- Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1.
⇒ Cấu hình electron nguyên tử của X là 1s22s22p63s23p1.
⇒ Lớp ngoài cùng có 3 electron.
⇒ Nguyên tố X là kim loại.
- Nguyên tử của nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3.
⇒ Cấu hình electron nguyên tử của Y là 1s22s22p63s23p3.
⇒ Lớp ngoài cùng có 5 electron.
⇒ Nguyên tố Y là phi kim.
Câu 10 trang 27 Hóa học 10: Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Xác định điện tích hạt nhân, số proton, số electron, số neutron và số khối của X.
Lời giải:
Gọi số hạt proton, electron, neutron lần lượt là p, e, n.
Ta có:
⇒ Số proton = số electron = 16 hạt, số neutron = 17 hạt
⇒ Điện tích hạt nhân là +16 và số khối A = 16 + 17 = 33
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Hóa 10 Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Hóa 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Hóa 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Hóa 10 Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

