Giải Hóa học 10 trang 69 Kết nối tri thức
Với Giải Hóa học 10 trang 69 trong Bài 14: Ôn tập chương 3 Hóa học 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 69.
Giải Hóa học 10 trang 69 Kết nối tri thức
Câu 1 trang 69 Hóa học 10: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
A. Cl2, Br2, I2, HCl.
B. Na2O, KCl, BaCl2, Al2O3.
C. HCl, H2S, NaCl, N2O.
D. MgO, H2SO4, H3PO4, HCl.
Lời giải:
Đáp án B
Các hợp chất ion thường được tạo bởi các kim loại điển hình (IA, IIA) với phi kim điển hình (O, VIIA).
⇒ Na2O, KCl, BaCl2, Al2O3 là các hợp chất ion.
Câu 2 trang 69 Hóa học 10: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
A N2, CO2, Cl2, H2.
B. N2, Cl2, H2, HCl.
C. N2, Hl, Cl2, CH4.
D. Cl2, O2, N2, F2.
Lời giải:
Đáp án D
Liên kết cộng hóa trị không phân cực là loại liên kết trong các đơn chất.
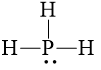
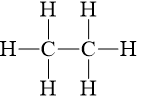
Câu 3 trang 69 Hóa học 10: Viết công thức cấu tạo và công thức Lewis của các phân tử sau PH3, H2O, C2H6. Trong phân tử nào có liên kết phân cực mạnh nhất.
Lời giải:
|
Công thức cấu tạo |
Công thức Lewis |
PH3 |
||
H2O |
H – O – H |
|
C2H6 |
- Các nguyên tử O, P, N đều tạo liên kết phân cực với H, trong đó nguyên tử O có độ âm điện lớn hơn cả nên liên kết O – H sẽ phân cực nhất.
⇒ Phân tử H2O có liên kết phân cực mạnh nhất.
Câu 4 trang 69 Hóa học 10: Dựa vào giá trị đó âm điện của các nguyên tử trong Bảng 6.2, xác định loại liên kết trong phân tử các chất CH4, CaCl2, HBr, NH3.
Lời giải:
Trong phân tử CH4, hiệu độ âm điện của C và H: 2,55 – 2,2 = 0,35
⇒ Liên kết giữa C và H là liên kết cộng hóa trị không phân cực.
Trong phân tử CaCl2, hiệu độ âm điện của Ca và Cl: 3,16 – 1 = 2,16
⇒ Liên kết giữa Ca và Cl là liên kết ion.
Trong phân tử HBr, hiệu độ âm điện của H và Br: 2,96 – 2,2 = 0,76
⇒ Liên kết giữa H và Br là liên kết cộng hóa trị phân cực.
Trong phân tử NH3, hiệu độ âm điện của N và H: 3,04 – 2,2 = 0,84
⇒ Liên kết giữa N và H là liên kết cộng hóa trị phân cực.
Câu 5 trang 69 Hóa học 10: Cho dãy các oxide sau Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
b) Dựa vào giá trị độ âm điện của các nguyên tố trong Bảng 6.2, cho biết loại liên kết (ion, cộng hoá trị phân cực, cộng hóa trị không phân cực) trong từng phân tử oxide.
Lời giải:
a) Độ phân cực trong dãy oxide giảm dần theo chiều từ trái sang phải:
Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
Do hiệu độ âm điện giảm dần.
b) Hiệu độ âm điện của nguyên tố kim loại với oxi là:
Na2O: |∆χNa - O| = 2,51 ⇒ Liên kết giữa Na và O là liên kết ion.
MgO: |∆χMg - O| = 2,13 ⇒ Liên kết giữa Mg và O là liên kết ion.
Al2O3: |∆χAl - O| = 1,83 ⇒ Liên kết giữa Al và O là liên kết ion.
SiO2: |∆χSi - O| = 1,54 ⇒ Liên kết giữa Si và O là liên kết cộng hóa trị có cực
P2O5: |∆χP - O| = 1,25 ⇒ Liên kết giữa P và O là liên kết cộng hóa trị có cực
SO3: |∆χS - O| = 0,86 ⇒ Liên kết giữa S và O là liên kết cộng hóa trị có cực
Cl2O7: |∆χCl - O| = 0,28 ⇒ Liên kết giữa Cl và O là liên kết cộng hóa trị không cực
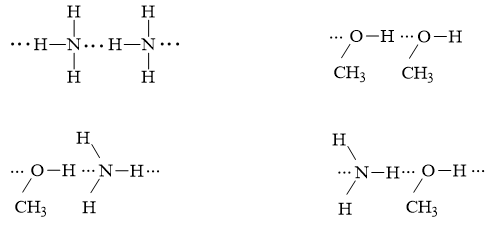
Câu 6 trang 69 Hóa học 10: a) Cho dãy các phân tử C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó.
Lời giải:
a) Phân tử CH3OH và NH3 có thể tạo liên kết hydrogen vì trong phân tử chứa nguyên tử có độ âm điện lớn (O và N) có cặp electron chưa liên kết và nguyên tử H linh động (có một phần điện tích dương (δ+) đủ lớn để hút cặp electron chưa liên kết của các nguyên tử O, N).
b) Sơ đồ biểu diễn liên kết hydrogen:
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT

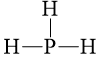
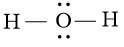



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

