Giải Hóa học 12 trang 138 Cánh diều
Với Giải Hóa học 12 trang 138 trong Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất Hóa 12 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa 12 trang 138.
Giải Hóa học 12 trang 138 Cánh diều
Thí nghiệm 1 trang 138 Hóa học 12: Xác định nồng độ của dung dịch FeSO4 bằng dung dịch KMnO4 (dung dịch thuốc tím)
Chuẩn bị:
- Hoá chất: Dung dịch thuốc tím KMnO4 có nồng độ chính xác 0,02 M, dung dịch FeSO4 có nồng độ khoảng 0,1 M; dung dịch H2SO4 20%.
- Dụng cụ : Burette loại 25 mL, bình tam giác loại 100 mL.
Tiến hành:
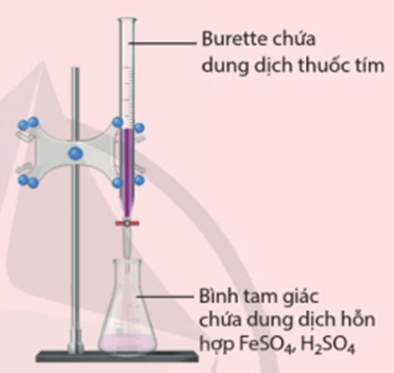
Hình 20.1. Bộ dụng cụ thí nghiệm chuẩn độ muối FeSO4 trong môi trường acid bằng dung dịch thuốc tím
- Lắp bộ dụng cụ như Hình 20.1. Cho dung dịch thuốc tím vào burette đến vạch 0, đồng thời bảo đảm không còn bọt khí trong burette. Cho 10 mL dung dịch FeSO4 và 5 mL dung dịch H2SO4 20% vào bình tam giác.
- Mở khoá để nhỏ từ từ từng giọt dung dịch thuốc tím vào bình tam giác, đồng thời lắc đều bình.
- Tiếp tục nhỏ dung dịch thuốc tím (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt bởi một giọt thuốc tím dư, không mất màu trong khoảng 20 giây thì kết thúc chuẩn độ (khoá burette).
- Ghi lại thể tích dung dịch thuốc tím đã dùng.
Lặp lại thí nghiệm ít nhất hai lần nữa.
Yêu cầu: Xác định nồng độ của dung dịch FeSO4. Biết phương trình hoá học của phản ứng diễn ra trong quá trình chuẩn độ là:
5Fe2+(aq) + (aq) + 8H+(aq) →5Fe3+(aq) + Mn2+(aq) + 4H₂O(1)
Lời giải:
Gọi thể tích dung dịch KMnO4 đã dùng ở các lần đo lần lượt là V1, V2, …, Vn
Ta có thể tích trung bình của dung dịch KMnO4 là:
Theo phương trình chuẩn độ, ta có:
⇒
Thay số liệu vào công thức trên ta xác định được nồng độ của dung dịch FeSO4.
Thí nghiệm 2 trang 138 Hóa học 12: Kiểm tra sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch
Chuẩn bị:
- Hoá chất: Các dung dịch CuSO4 0,1 M; FeCl3 0,1 M; NaOH 0,1 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành:
- Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch CuSO4.
- Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch FeCl3.
Yêu cầu: Quan sát, giải thích hiện tượng và viết phương trình hoá học minh hoạ.
Lời giải:
Hiện tượng:
- Ở ống nghiệm chứa dung dịch CuSO4: xuất hiện kết tủa màu xanh, đó là Cu(OH)2.
- Ở ống nghiệm chứa dung dịch FeCl3: xuất hiện kết tủa màu nâu đỏ, đó là Fe(OH)3.
Phương trình hóa học:
2NaOH(aq) + CuSO4(aq) ⟶ Cu(OH)2(s) + Na2SO4(aq)
3NaOH(aq) + FeCl3(aq) ⟶ Fe(OH)3(s) + 3NaCl(aq)
Lời giải Hóa 12 Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất hay khác:
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Cánh diều
- Giải Chuyên đề học tập Hóa 12 Cánh diều
- Giải SBT Hóa học 12 Cánh diều
- Giải lớp 12 Cánh diều (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

