Lý thuyết Hóa 10 Chương 3 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Tổng hợp Lý thuyết Hóa học 10 Chương 3 Kết nối tri thức, Chân trời sáng tạo, Cánh diều hay, chi tiết giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn tập để học tốt Hóa 10 Chương 3. Bạn vào tên chương hoặc Xem chi tiết để theo dõi bài viết.
Tóm tắt lý thuyết Hóa học 10 Chương 3 sách mới
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Lưu trữ: Lý thuyết Hóa học 10 Chương 3: Liên kết hóa học (sách cũ)
I. So sánh liên kết ion, liên kết cộng hóa trị và liên kết kim loại
1. So sánh liên kết ion, liên kết cộng hóa trị
a. Giống nhau: Liên kết ion và liên kết CHT giống nhau về nguyên nhân hình thành liên kết. Các nguyên tử liên kết với nhau tạo thành phân tử để có cấu hình electron bền vững của khí hiếm.
b. Khác nhau: Liên kết ion và liên kết CHT khác nhau về bản chất liên kết và điều kiện liên kết:
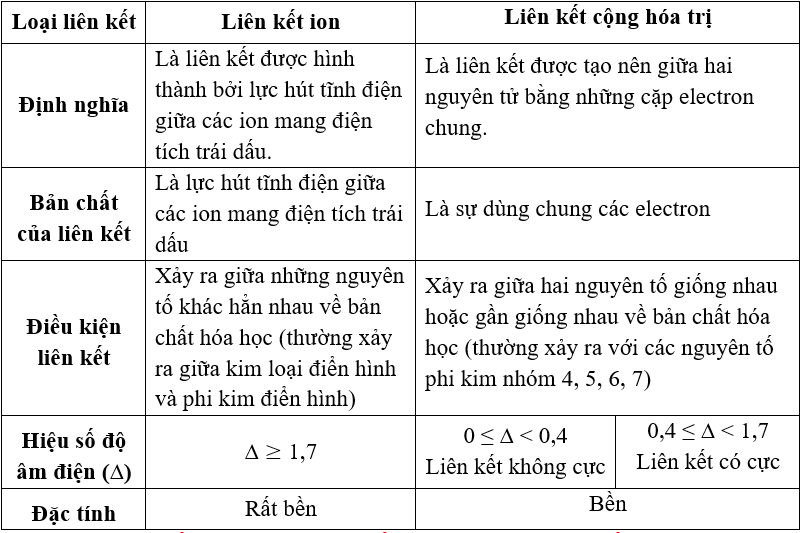
2. So sánh liên kết kim loại với liên kết cộng hóa trị và liên kết ion
- Liên kết kim loại và liên kết cộng hóa trị giống nhau là có những electron chung của các nguyên tử. Nhưng electron chung trong liên kết kết kim loại là của tất cả những nguyên tử kim loại có mặt trong đơn chất.
- Liên kết kim loại và liên kết ion cũng là lực hút tĩnh điện giữa các phần tử điện tích trái dấu. Khác nhau, các phần tử tích điện trái dấu trong liên kết KL là ion dương và các electron tự do.
II. Hóa trị và số oxi hóa
1. Hóa trị trong hợp chất ion
- Hóa trị của nguyên tố trong hợp chất ion được gọi là điện hóa trị.
- Điện hóa trị của một nguyên tố bằng số electron mà nguyên tử cả nguyên tố đó nhường hoặc thu để tạo thành ion.
2. Hóa trị trong hợp chất cộng hóa trị
- Hóa trị của một nguyên tố trong hợp chất cộng hóa trị được gọi là cộng hóa trị.
- Cộng hóa trị của một nguyên tố bằng số liên kết mà nguyên tử của nguyên tố đó tạo ra được với nguyên tử của nguyên tố khác trong phân tử.
3. Số oxi hóa
- Số oxi hóa của một nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định liên kết giữa các nguyên tử trong phân tử là liên kết ion.
- Cách xác định số oxi hóa:
+ Quy tắc 1: Số OXH của các nguyên tố trong các đơn chất bằng 0.
+ Quy tắc 2: Trong 1 phân tử, tổng số OXH của các nguyên tố bằng 0.
+ Quy tắc 3: Số OXH của các ion đơn nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử , tổng số OXH của các nguyên tố bằng điện tích của ion.
+ Quy tắc 4: Trong hầu hết các hợp chất, số OXH của H bằng +1 , trừ 1 số trường hợp như hidrua, kim loại (NaH, CaH2, …). Số OXH của O bằng –2 trừ trường hợp OF2, peoxit (chẳng hạn H2O2 …).
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Khái niệm về liên kết hóa học. Liên kết ion
- Lý thuyết Luyện tập về liên kết ion. Liên kết cộng hóa trị. Lai hóa các obitan nguyên tử
- Lý thuyết Hiệu độ âm điện và liên kết hóa học
- Lý thuyết Liên kết kim loại
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

