30 Bài tập về nitric acid (HNO3) và muối nitrate cực hay (có lời giải)
Với 30 Bài tập về nitric acid (HNO3) và muối nitrate có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm Bài tập về nitric acid (HNO3) và muối nitrate.
30 Bài tập về nitric acid (HNO3) và muối nitrate cực hay (có lời giải)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Câu 1 . Nitric acid tinh khiết là chất lỏng không màu nhưng trong phòng thí nghiệm lọ nitric acid đặc có màu nâu vàng hoặc nâu là do nguyên nhân nào sau?
A. HNO3 oxi hóa bụi bẩn trong không khí tạo hợp chất có màu.
B. HNO3 tự biến đổi thành hợp chất có màu.
C. HNO3 bị phân hủy 1 ít tạo NO2 tan lại trong HNO3 lỏng.
D. HNO3 hút nước mạnh tạo dung dịch có màu.
Lời giải:
Đáp án C
HNO3 kém bền, ngay trong điều kiện thường, khi có ánh sáng, dung dịch HNO3 bị phân hủy một phần giải phóng NO2. Khí này tan trong dung dịch axit, làm dung dịch có màu vàng.
4HNO3 → 4NO2 + O2 + 2H2O
Câu 2 . Trong phòng thí nghiệm người ta thường điều chế HNO3 từ
A. NH3 và O2.
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO3 và HCl đặc.
Lời giải:
Đáp án C
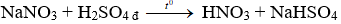
Câu 3 . Khi nhiệt phân, dãy muối nitrate nào đều cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi?
A. Cu(NO3)2, Fe(NO3)2, Pb(NO3)2.
B. Cu(NO3)2, LiNO3, KNO3.
C. Hg(NO3)2, AgNO3, KNO3.
D. Zn(NO3)2, KNO3, Pb(NO3)2.
Lời giải:
Đáp án A
Muối nitrate của các kim loại magie, kẽm, sắt, chì, đồng… bị phân hủy tạo thành oxit kim loại tương ứng, khí NO2 và khí O2.
2Cu(NO3)2 → 2CuO + 4NO2 + O2
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
2Pb(NO3)2 → 2PbO + 4NO2 + O2
Câu 4 . Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là
A. Khí màu nâu đỏ bay lên, dung dịch chuyển màu xanh.
B. Khí không màu bay lên, dung dịch chuyển màu xanh.
C. Khí không màu bay lên, dung dịch có màu nâu.
D. Cu không tác dụng với HNO3.
Lời giải:
Đáp án A
Cu + 4HNO3 đặc → Cu(NO3)2 (dd màu xanh) + 2NO2 ↑ (nâu đỏ) + 2H2O
Câu 5 . Phát biểu sai là
A. Muối nitrate được sử dụng chủ yếu để làm phân đạm trong nông nghiệp.
B. Nhiều chất hữu cơ bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
C. HNO3 là một axit mạnh, có tính oxi hóa mạnh.
D. HNO3 đặc khi tác dụng với C, S, P nó khử các phi kim đến mức oxi hóa cao nhất.
Lời giải:
Đáp án D
HNO3 đặc khi tác dụng với C, S, P nó oxi hóa các phi kim đến mức oxi hóa cao nhất.
Câu 6 . Trong những nhận xét dưới đây về muối nitrate của kim loại, nhận xét sai là
A. Tất cả các muối nitrate đều dễ tan trong nước.
B. Các muối nitrate là chất điện li mạnh, trong dung dịch loãng chúng phân li hoàn toàn thành các ion.
C. Các muối nitrate dễ bị nhiệt phân hủy.
D. Các muối nitrate chỉ được sử dụng làm phân bón hóa học trong nông nghiệp.
Lời giải:
Đáp án D
Các muối nitrate được sử dụng chủ yếu làm phân bón hóa học trong nông nghiệp, ngoài ra còn được sử dụng làm thuốc nổ đen...
Câu 7 . Thí nghiệm với dd HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, biện pháp hiệu quả nhất là người ta thường nút ống nghiệm bằng
A. bông khô.
B. bông có tẩm nước.
C. bông có tẩm nước vôi.
D. bông có tẩm giấm ăn.
Lời giải:
Đáp án C
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O.
Câu 8 . Khi cho kim loại tác dụng với HNO3 không thể tạo ra hợp chất nào sau?
A. NO.
B. NH4NO3.
C. NO2.
D. N2O5.
Lời giải:
Đáp án D
Câu 9 . Nhóm các kim loại đều không phản ứng được với HNO3 loãng là
A. Al, Fe.
B. Au, Pt.
C. Al, Au.
D. Fe, Pt.
Lời giải:
Đáp án B
HNO3 oxi hóa được hầu hết các kim loại trừ Au và Pt.
Câu 10 . Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3 đặc, nguội là
A. Fe, Al, Cr.
B. Cu, Fe, Al.
C. Fe, Mg, Al.
D. Cu, Pb, Ag.
Lời giải:
Đáp án A
Fe, Al, Cr bị thụ động trong HNO3 đặc, nguội.
Câu 11 . Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3?
A. HCl.
B. HNO3.
C. KBr.
D. K3PO4.
Lời giải:
Đáp án B
HCl + AgNO3 → AgCl↓ + HNO3
HNO3 + AgNO3 → không phản ứng
KBr + AgNO3 → AgBr↓ + KNO3
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3.
Câu 12 . Sản phẩm của phản ứng nhiệt phân Cu(NO3)2 là
A. CuO, NO và O2.
B. Cu(NO2)2 và O2.
C. Cu(NO3)2, NO2 và O2.
D. CuO, NO2 và O2.
Lời giải:
Đáp án D
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Câu 13 . Sản phẩm của phản ứng nhiệt phân KNO3 là
A. K2O, NO2 và O2 .
B. K, NO2, O2.
C. KNO2, NO2 và O2.
D. KNO2 và O2.
Lời giải:
Đáp án D
2KNO3 → 2KNO2 + O2
Câu 14 . Sản phẩm của phản ứng nhiệt phân hoàn toàn AgNO3 là
A. Ag2O, NO2, O2.
B. Ag, NO, O2.
C. Ag2O, NO, O2.
D. Ag, NO2, O2.
Lời giải:
Đáp án D
2AgNO3 → 2Ag + 2NO2 + O2
Câu 15 . Khi cho Cu tác dụng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là
A. chất xúc tác.
B. chất oxi hoá.
C. môi trường.
D. chất khử.
Lời giải:
Đáp án B
3Cu + 4H2SO4 + 2NaNO3 → 3CuSO4 + 2NO +Na2SO4 + 4H2O.
Số oxi hóa của N giảm từ +5 xuống +2, NaNO3 đóng vai trò là chất oxi hóa.
Câu 16 . Kim loại M phản ứng được với các dung dịch: HCl, Cu(NO3)2, HNO3 đặc nguội. Kim loại M là
A. Ag.
B. Zn.
C. Fe.
D. Al.
Lời giải:
Đáp án B
Zn + 2HCl → ZnCl2 + H2
Zn + Cu(NO3)2 → Cu + Zn(NO3)2.
Zn + 4HNO3 đặc → Zn(NO3)2 + 2NO2 + 2H2O.
Câu 17 . Cho hỗn hợp bột Al, Fe vào dung dịch chứa Cu(NO3)2 và AgNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn gồm ba kim loại là
A. Al, Cu, Ag.
B. Al, Fe, Cu.
C. Fe, Cu, Ag.
D. Al, Fe, Ag
Lời giải:
Đáp án C
Al + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe(NO3)2 + AgNO3 → Ag + Fe(NO3)3
Do thu được 3 kim loại nên có Fe dư.
Vậy 3 kim loại là Fe, Cu, Ag.
Câu 18 . Phản ứng hóa học viết đúng là
A. 5Cu + 12HNO3 đặc → 5Cu(NO3)2 + N2↑ + 6H2O.
B. Mg + 4HNO3 loãng → Mg(NO3)2 + 2NO2↑ + 2H2O.
C. 8Al + 30HNO3 loãng → 8Al(NO3)3 + 3N2O↑ + 15H2O.
D. Tất cả đều đúng.
Lời giải:
Đáp án C
Thông thường kim loại tác dụng với HNO3 đặc cho sản phẩm khử là NO2, kim loại tác dụng với HNO3 loãng cho sản phẩm khử là NO.
Với kim loại có tính khử mạnh như Al, Mg … sản phẩm khử có thể là N2, N2O hoặc NH4NO3.
Câu 19 . Kim loại bị thụ động trong HNO3 đặc, nguội là
A. Al, Fe.
B. Ag, Fe.
C. Pb, Ag.
D. Pt, Au.
Lời giải:
Đáp án A
Al, Fe bị thụ động trong HNO3 đặc, nguội.
Câu 20 . Cho hổn hợp C và S vào dung dịch HNO3 đặc thu được hổn hợp khí X và dung dịch Y. Thành phần của X là
A. SO2 và NO2.
B. CO2 và SO2.
C. SO2 và CO2.
D. CO2 và NO2.
Lời giải:
Đáp án D
C + 4HNO3 đ → CO2 + 4NO2 + 2H2O
S + 6HNO3 đ → H2SO4 + 6NO2 + 2H2O.
Câu 21 . Cho 25,2 gam Fe tác dụng với HNO3 loãng, đun nóng thu được khí NO là sản phẩm khử duy nhất và một dung dịch Z, còn lại 1,4 gam kim loại không tan. Khối lượng muối trong dung dịch Z là
A. 76,5 gam.
B. 82,5 gam.
C. 126,2 gam.
D. 180,2 gam.
Lời giải:
Đáp án A
Do sau phản ứng vẫn còn kim loại nên sau phản ứng chỉ thu được muối Fe(NO3)2.
Bảo toàn nguyên tố Fe có nmuối = nFe phản ứng = (25,2 - 1,4):56 = 0,425 mol
mmuối = 0,425.(56 + 62.2) = 76,5 gam.
Câu 22 . Hoà tan hoàn toàn 9,45 gam kim loại X bằng HNO3 loãng thu được 5,04 lít (đktc) hỗn hợp khí N2O và NO (không có sản phẩm khử khác), trong đó số mol NO gấp 2 lần số mol N2O. Kim loại X là
A. Zn.
B. Cu.
C. Al.
D. Fe.
Lời giải:
Đáp án C
nhh khí = 5,04 : 22,4 = 0,225 mol
Gọi số mol N2O là a → nNO = 2a → a = 0,075 mol
Gọi số mol X là x mol. Theo bài ra ta có các quá trình:
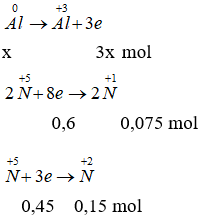
Áp dụng định luật bảo toàn số mol electron ta có: ne nhường = ne nhận
→ 3x = 0,6 + 0,45
→ x = 0,35 → MX = 9,45 : 0,35 = 27 → X là Nhôm.
Câu 23 . Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3,Fe3O4,Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4,Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá - khử là
A. 8.
B. 5.
C. 7.
D. 6.
Lời giải:
Đáp án C
Những chất mà Fe trong chất đã có số oxi hóa cao nhất là +3 khi phản ứng với HNO3 thì Fe không thể tăng số oxi hóa được nữa. Do đó những phản ứng đó không phải là phản ứng oxi hóa – khử.
Vậy những chất phản ứng với HNO3 được phản ứng oxi hóa – khử là: Fe, FeO, Fe(OH)2,Fe3O4, Fe(NO3)2, FeSO4, FeCO3.
Câu 24 . Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 10.
B. 11.
C. 8.
D. 9.
Lời giải:
Đáp án A
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
→ Tổng hệ số nguyên, tối giản trong phương trình = 1 + 4 + 1 + 2 + 2 = 10.
Câu 25 . Cho phương trình phản ứng: a Al + b HNO3 → c Al(NO3)3 + d NO + e H2O
Tỉ lệ a: b là
A. 2: 3.
B. 2: 5.
C. 1: 3.
D. 1: 4.
Lời giải:
Đáp án D
Al + 4 HNO3 → Al(NO3)3 + NO + 2H2O
Tỉ lệ a: b là 1: 4.
Câu 26 . Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
A. 6.
B. 10.
C. 8.
D. 4.
Lời giải:
Đáp án B
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Câu 27 . Thuốc thử dùng để nhận biết ba axit đặc nguội HNO3, H2SO4, HCl đựng trong ba lọ mất nhãn
A. Cu.
B. Al.
C. Fe.
D. CuO.
Lời giải:
Đáp án A
Đánh STT từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Lần lượt cho vào mỗi ống nghiệm một mẩu Cu.
Ống nghiệm nào có khí màu nâu đỏ thoát ra là ống nghiệm chứa HNO3 đặc.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O.
Đun nóng hai ống nghiệm còn lại. Ống nghiệm nào mẩu Cu tan dần, có khí mùi xốc thoát ra là ống nghiệm chứa H2SO4 đặc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
Câu 28 . Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng dư thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 4,05.
B. 2,70.
C. 8,10.
D. 5,40.
Lời giải:
Đáp án D
Áp dụng định luật bảo toàn mol electron có:
3.nAl = 3.nNO → nAl = nNO = 0,2 mol → m = 0,2.27 = 5,4 gam.
Câu 29 . Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là
A. 18,90 gam.
B. 37,80 gam.
C. 39,80 gam.
D. 28,35 gam.
Lời giải:
Đáp án C
nZn = 0,2 mol; nN2 = 0,02 mol.
Giả sử sản phẩm khử sinh ra chỉ có N2. Ta có nZn.2 = 0,4 ≠ nN2.10 = 0,2.
Vậy còn có sản phẩm khử là NH4NO3 x mol
Áp dụng định luật bảo toàn electron có: nZn.2 = nN2.10 + nNH4NO3.8
→ nNH4NO3 = 0,025 mol.
Muối trong X gồm Zn(NO3)2 và NH4NO3.
Bảo toàn nguyên tố Zn có nZn(NO3)2 = nZn = 0,2
→ mmuối = 0,2.(65 + 62.2) + 0,025.(18 + 62) = 39,80 gam.
Câu 30 . Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, ở đktc). Khí X là
A. N2O.
B. NO2.
C. N2.
D. NO.
Lời giải:
Đáp án D
nMg = 0,15 mol; nx = 0,1 mol
Áp dụng định luật bảo toàn electron có:
nMg.2 = nx. n ( với n là số e nhận)
→ 0,15.2 = 0,1.n → n = 3. Vậy khí X là NO.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Bài tập về phosphoric acid và Muối Photphat cực hay (có lời giải)
- Bài tập về Nitơ (N2) cực hay (có lời giải)
- Bài tập về Phân bón hóa học cực hay (có lời giải)
- Bài tập về Photpho (P) cực hay (có lời giải)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

