Lý thuyết Hợp chất của Cacbon (hay, chi tiết nhất)
Bài viết Lý thuyết Hợp chất của Cacbon hay, chi tiết giúp bạn nắm vứng kiến thức trọng tâm về Hợp chất của Cacbon.
Lý thuyết Hợp chất của Cacbon (hay, chi tiết nhất)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Bài 16 : Hợp chất của cacbon - Cô Nguyễn Nhàn (Giáo viên VietJack)
I. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo của CO là C≡O (trong đó có 1 liên kết thuộc kiểu cho - nhận).
- CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt.
- CO là khí độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển khí O2.
II. Tính chất hóa học
- Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao.
- CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
- CO là chất khử mạnh.
+ Tác dụng với các phi kim:
2CO + O2 → 2CO2 (700ºC)
CO + Cl2 → COCl2 (photgen)
+ CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
3CO + Fe2O3 → 3CO2 + 2Fe
CO + CuO → CO2 + Cu
III. Điều chế
- Trong công nghiệp: Khí CO được điều chế theo hai phương pháp:
+ Khí than ướt
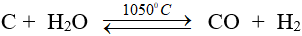
+ Khí lò gas
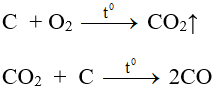
- Trong phòng thí nghiệm:
HCOOH → CO + H2O (H2SO4 đặc, tº)
B. Carbon dioxide (CO2)
I. Cấu tạo phân tử và tính chất vật lý
1. Cấu tạo phân tử
- Cấu tạo của CO2 là O=C=O.
2. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
II. Tính chất hóa học
- Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
1. CO2 là acidic oxide
- CO2 tan trong nước tạo thành carbonic acid (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇋ H2CO3 (dd)
- CO2 tác dụng với basic oxide → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
2. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇋ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C
(Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
3. CO2 còn được dùng để sản xuất ure.
CO2 + 2NH3 → NH4O-CO-NH2 (amoni cacbamat)
NH4O-CO-NH2 → H2O + (NH2)2CO (180ºC; 200at)
III. Điều chế
- Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
- Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
- Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
- Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
C. Carbonic acid và muối carbonate
I. Carbonic acid (H2CO3)
- Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O.
- Là axit hai nấc, trong dung dịch phân li hai nấc.
H2CO3 ⇋ H+ + HCO3-
HCO3- ⇋ H+ + CO32-
II. Muối Cabonat
Là muối của carbonic acid (gồm muối CO32- và HCO3-).
1. Tính tan
- Muối carbonate của các kim loại kiềm, amoni và đa số muối hydrocarbon?t đều tan. Muối carbonate của kim loại khác thì không tan.
2. Tính chất hóa học
- Tính chất hóa học chung của muối:
+ Tác dụng với axit → muối mới + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
Chú ý:
Nếu cho H+ vào muối tan thì CO32- → HCO3- → H2O + CO2.
Nếu cho H+ vào muối không tan thì CO32- → CO2 + H2O.
+ Tác dụng với dung dịch kiềm → muối mới + bazơ mới.
NaHCO3 + NaOH → Na2CO3 + H2O
+ Tác dụng với muối → 2 muối mới.
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
+ Tác dụng với kim loại đứng trước kim loại tạo muối → muối mới + kim loại mới.
Cu(HCO3)2 + Mg → Mg(HCO3)2 + Cu
- Phản ứng thủy phân: Muối carbonate của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm:
Na2CO3 → 2Na+ + CO32-
CO32- + H2O ⇋ HCO3- + OH-
→ Trong một số phản ứng trao đổi Na2CO3 đóng vai trò như 1 bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
Chú ý: Muối (NH4)2CO3 có môi trường trung tính.
- Phản ứng nhiệt phân:
+ Muối carbonate tan không bị nhiệt phân (trừ muối amoni), muối carbonate không tan bị nhiệt phân:
MgCO3 → MgO + CO2 (tº)
+ Tất cả các muối hydrocarbon?t đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2 + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2
3. Nhận biết
Cho tác dụng với axit → CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
4. Tính chất và ứng dụng của một số muối carbonate
- Canxi carbonate (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất dộn trong cao su và 1 số ngành công nghiệp.
- Natricarbonate (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
- Natri hydrocarbon?t (NaHCO3) là chất tinh thể màu trắng, hơi ít tan trong nước. Dùng trong công nghiệp thực phẩm, trong y học dùng làm thuốc giảm đau dạ dày.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Cacbon
- Lý thuyết Silic và hợp chất của Silic
- Lý thuyết Công nghiệp silicat
- Lý thuyết tính chất hóa học của cacbon, silic và hợp chất của chúng
- Dạng 1: Bài tập lý thuyết về tính chất hóa học của Cacbon, Silic
- Dạng 2: Bài tập CO2 tác dụng với dung dịch kiềm
- Dạng 3: Bài toán khử oxit kim loại bằng C và CO
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

