Lý thuyết Giới thiệu về liên kết hóa học (KHTN 7 Kết nối tri thức Bài 6)
Với tóm tắt lý thuyết Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học sách Kết nối tri thức hay nhất, ngắn gọn sẽ giúp học sinh lớp 7 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Lý thuyết Giới thiệu về liên kết hóa học (KHTN 7 Kết nối tri thức Bài 6)
(199k) Xem Khóa học KHTN 7 KNTT
Chỉ từ 150k mua trọn bộ lý thuyết KHTN 7 Kết nối tri thức (cả năm) bản word trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
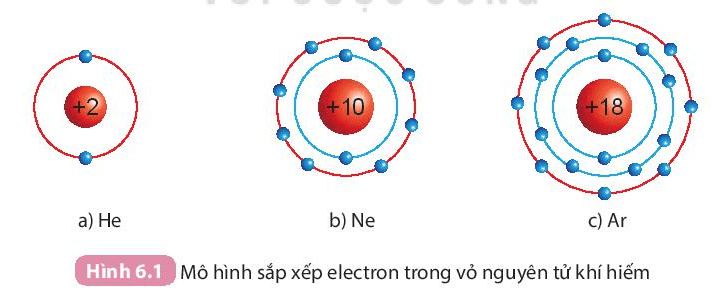
I. Cấu trúc electron bền vững của khí hiếm
- Ở điều kiện thường, các khí hiếm tồn tại dưới dạng đơn nguyên tử bền vững, khó bị biến đổi hóa học. Lớp electron ngoài cùng của chúng chứa 8 electron (trừ He chứa 2 electron).
- Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung electron.
II. Liên kết ion
- Nguyên tử trung hòa về điện, khi nguyên tử nhường hay nhận electron, nó trở thành phần tử mang điện gọi là ion.
- Điện tích của ion được viết phía trên, bên phải của kí hiệu hóa học.
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
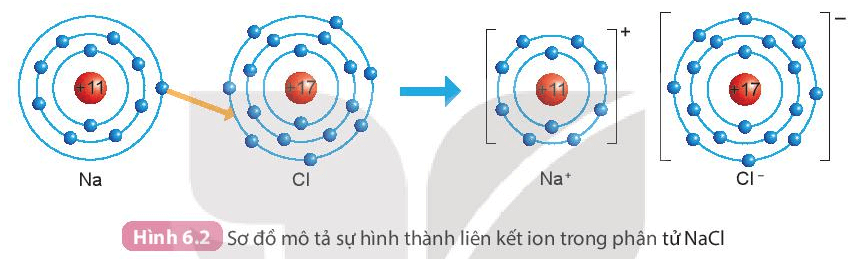
- Sự hình thành liên kết trong phân tử muối ăn (sodium chloride NaCl):
+ Nguyên tử sodium (Na) nhường một electron ở lớp ngoài cùng cho nguyên tử chlorine (Cl) để tạo thành ion dương Na+ có lớp vỏ bền vững giống vỏ nguyên tử khí hiếm Ne.
+ Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion âm Cl- có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar.
+ Hai ion được tạo thành mang điện tích trái dấu hút nhau tạo thành liên kết ion trong phân tử muối ăn.
- Chú ý:
+ Khi kim loại tác dụng với phi kim, nguyên tử kim loại nhường electron cho phi kim.
Nguyên tử kim loại trở thành ion dương và nguyên tử phi kim chuyển thành ion âm.
+ Liên kết ion thường được tạo thành giữa kim loại điển hình và phi kim điển hình.
+ Hợp chất ion như muối ăn … là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy và khi tan trong nước tạo thành dung dịch dẫn được điện.
III. Liên kết cộng hóa trị
Liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều cặp electron.
1. Liên kết cộng hóa trị trong phân tử đơn chất
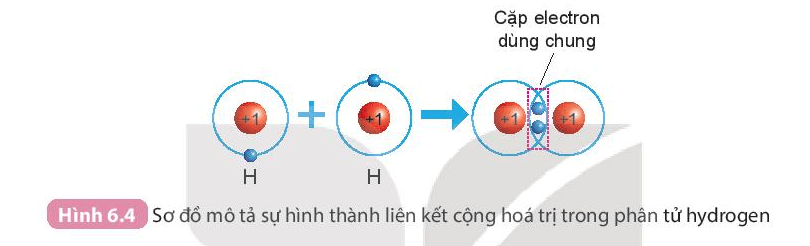
a) Sự hình thành phân tử hydrogen
- Mỗi nguyên tử H có một electron ở lớp ngoài cùng.
- Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử hydrogen, hai nguyên tử H đã liên kết với nhau bằng cách mỗi nguyên tử H góp chung 1 electron tạo thành 1 cặp electron dùng chung.
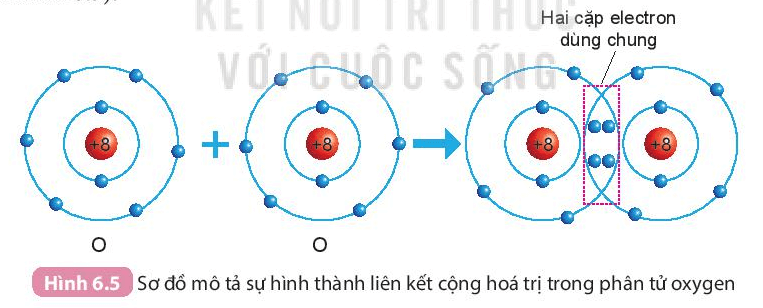
b) Sự hình thành phân tử oxygen
- Mỗi nguyên tử O có 6 electron ở lớp ngoài cùng.
- Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử oxygen, hai nguyên tử O đã liên kết với nhau bằng cách mỗi nguyên tử O góp chung 2 electron để tạo thành 2 cặp electron dùng chung.
Chú ý: Liên kết cộng hóa trị thường gặp nhiều trong phân tử đơn chất phi kim;
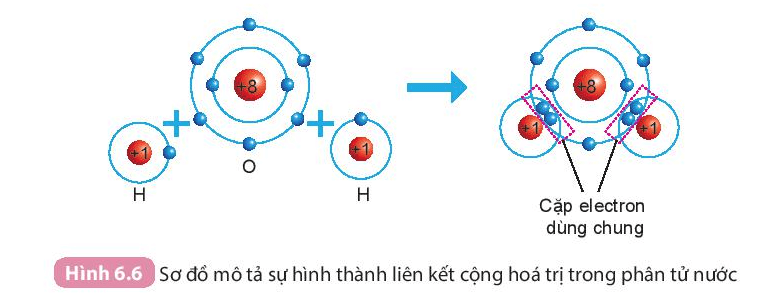
2. Liên kết cộng hóa trị trong phân tử hợp chất
Sự hình thành phân tử nước
Khi hình thành phân tử nước, hai nguyên tử H đã liên kết với 1 nguyên tử O bằng cách nguyên tử O góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
Chú ý:
+ Các chất ammonia, carbon dioxide, đường ăn … cũng là các hợp chất cộng hóa trị;
+ Hợp chất cộng hóa trị có thể là chất rắn, chất lỏng hoặc chất khí;
+ Các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
(199k) Xem Khóa học KHTN 7 KNTT
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Kết nối tri thức hay khác:
Xem thêm các tài liệu học tốt lớp 7 hay khác:
- Giải sgk Khoa học tự nhiên 7 Kết nối tri thức
- Giải SBT Khoa học tự nhiên 7 Kết nối tri thức
- Giải lớp 7 Kết nối tri thức (các môn học)
- Giải lớp 7 Chân trời sáng tạo (các môn học)
- Giải lớp 7 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải bài tập Khoa học tự nhiên lớp 7 của chúng tôi được biên soạn bám sát nội dung sgk Khoa học tự nhiên 7 bộ sách Kết nối tri thức với cuộc sống (NXB Giáo dục).
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 7 (hay nhất) - KNTT
- Soạn văn 7 (ngắn nhất) - KNTT
- Giải sgk Toán 7 - KNTT
- Giải Tiếng Anh 7 Global Success
- Giải Tiếng Anh 7 Friends plus
- Giải sgk Tiếng Anh 7 Smart World
- Giải Tiếng Anh 7 Explore English
- Giải sgk Khoa học tự nhiên 7 - KNTT
- Giải sgk Lịch Sử 7 - KNTT
- Giải sgk Địa Lí 7 - KNTT
- Giải sgk Giáo dục công dân 7 - KNTT
- Giải sgk Tin học 7 - KNTT
- Giải sgk Công nghệ 7 - KNTT
- Giải sgk Hoạt động trải nghiệm 7 - KNTT
- Giải sgk Âm nhạc 7 - KNTT




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

