Giải SBT Hóa học 10 trang 23 Chân trời sáng tạo
Với Giải SBT Hóa học 10 trang 23 trong Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm Sách bài tập Hóa 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 10 trang 23.
Giải SBT Hóa học 10 trang 23 Chân trời sáng tạo
Bài 6.8 trang 23 SBT Hóa học 10: Hydroxide nào có tính acid mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được dùng để phân hủy các quặng phức tạp; phân tích khoáng vật hoặc làm chất xúc tác.
A. Silicic acid
B. Sulfuric acid
C. Phosphoric acid
D. Perchloric acid
Lời giải:
Đáp án đúng là: D
Silicic acid: H2SiO3
Sulfuric acid: H2SO4
Phosphoric acid: H3PO4
Perchloric acid: HClO4.
Ta có Si, P, S, Cl thuộc cùng chu kì 3. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của các hydroxide tương ứng tăng dần.
Vậy tính acid: H2SiO3 < H3PO4 < H2SO4 < HClO4.
Bài 6.9 trang 23 SBT Hóa học 10: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát biểu nào sau đây sai?
A. Các nguyên tố này đều là các kim loại mạnh nhất trong chu kì.
B. Các nguyên tố này không cùng thuộc một chu kì.
C. Thứ tự tăng dần tính base là: X(OH)2, Y(OH)2, Z(OH)2
D. Thứ tự tăng dần độ âm điện là: Z, Y, X
Lời giải:
Đáp án đúng là: A
ZX = 4, X thuộc chu kì 2, nhóm IIA.
ZY = 12, Y thuộc chu kì 3, nhóm IIA.
ZZ = 20, Z thuộc chu kì 4, nhóm IIA.
A sai vì nguyên tố thuộc nhóm IA mới là các kim loại mạnh nhất trong chu kì.
B đúng vì X thuộc chu kì 2, Y thuộc chu kì 3, Z thuộc chu kì 4.
C đúng vì trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, tính base của các hydroxide tương ứng tăng dần.
D đúng vì trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân độ âm điện của các nguyên tố nhìn chung giảm dần.
Bài 6.10 trang 23 SBT Hóa học 10: Hãy cho biết:
a. Sự biến đổi tính kim loại và tính phi kim của nguyên tử một nguyên tố.
b. Quan hệ giữa tính phi kim và độ âm điện của nguyên tử một nguyên tố.
c. Quan hệ giữa sự biến đổi độ âm điện và tính phi kim của nguyên tử các nguyên tố nhóm A trong bảng tuần hoàn.
Lời giải:
a) Tính kim loại của nguyên tử một nguyên tó càng mạnh thì tính phi kim của nó càng yếu và ngược lại.
b) Độ âm điện của nguyên tử một nguyên tố càng lớn thì tính phi kim của nó càng mạnh.
c) Tính phi kim của nguyên tử các nguyên tố biến đổi cùng chiều với độ âm điện của chúng.
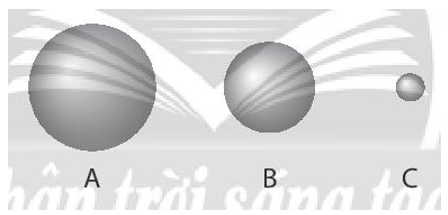
Bài 6.11 trang 23 SBT Hóa học 10: Quan sát hình sau:
3 quả cầu A, B, C tượng trưng cho nguyên tử các nguyên tố helium, krypton và radon. Quả cầu nào là krypton?
Lời giải:
He; Kr và Rn đều thuộc nhóm VIIIA. Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân bán kính nguyên tử tăng dần.
Vậy bán kính nguyên tử He < Kr < Rn.
Vậy quả cầu B tượng trưng cho nguyên tử của nguyên tố Kr (krypton).
Bài 6.12 trang 23 SBT Hóa học 10: Sắp xếp các nguyên tử sau đây theo thứ tự tăng dần độ âm điện: Cl, Al, Na, P, F.
Thứ tự tăng dần độ âm điện: Na < Al < P < Cl < F.
Lời giải:
Thứ tự tăng dần độ âm điện: Na < Al < P < Cl < F.
Bài 6.13 trang 23 SBT Hóa học 10: Sắp xếp các nguyên tử sau đây theo thứ tự giảm dần tính kim loại: Na, Al, Si, Mg, P, Cl, S, F.
Lời giải:
Thứ tự giảm dần tính kim loại: Na, Mg, Al, Si, P, S, Cl, F.
Bài 6.14 trang 23 SBT Hóa học 10: Viết phương trình phản ứng của các chất sau với nước (nếu có): Na2O, SO3, Cl2O7, CO2, CaO, N2O5. Nhận xét về tính base, tính acid của các sản phẩm tạo thành.
Lời giải:
Na2O + H2O → 2NaOH (base mạnh)
CaO + H2O → Ca(OH)2 (base mạnh)
CO2 + H2O ⇄ H2CO3 (acid yếu)
N2O5 + H2O → 2HNO3 (acid mạnh)
SO3 + H2O → H2SO4 (acid mạnh)
Cl2O7 + H2O → 2HClO4 (acid mạnh)
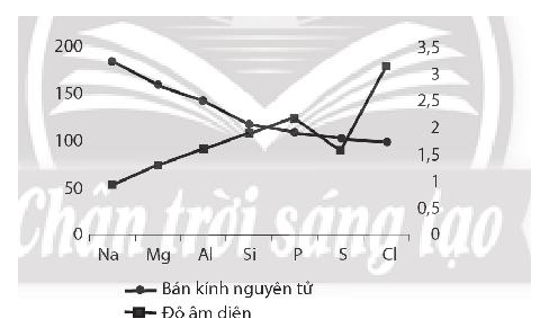
Bài 6.15 trang 23 SBT Hóa học 10: Dựa vào Hình 6.1 và Bảng 6.1 trong SGK, hãy vẽ đồ thị hoặc biểu đồ đối với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào. Giải thích.
Lời giải:
- Độ âm điện và bán kính nguyên tử của các nguyên tố trong chu kì biến đổi ngược chiều nhau. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố giảm dần, còn độ âm điện của các nguyên tố tăng dần.
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng theo, do đó độ âm điện của nguyên tử các nguyên tố thường tăng dần.
- Trong một chu kì, tuy nguyên tử của các nguyên tố có cùng số lớp electron nhưng khi điện tích hạt nhân tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng theo. Do đó, bán kính của nguyên tử các nguyên tố giảm khi đi từ đầu chu kì đến cuối chu kì.
Lời giải SBT Hóa 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm hay khác:
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

