Giải SBT Hóa học 10 trang 77 Chân trời sáng tạo
Với Giải SBT Hóa học 10 trang 77 trong Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA Hóa học lớp 10 Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 77.
Giải SBT Hóa học 10 trang 77 Chân trời sáng tạo
Bài 17.18 trang 77 SBT Hóa học 10: Hoàn thành phương trình hóa học của các phản ứng chứng minh tính chất halogen:
a.
b.
c.
d.
Nhận xét vai trò của halogen trong các phản ứng trên.
Lời giải:
a)
Br2 có vai trò là chất oxi hoá (số oxi hóa giảm sau phản ứng).
b)
F2 là chất oxi hoá (có số oxi hóa giảm sau phản ứng).
c)
Cl2 vừa là chất oxi hoá, vừa là chất khử (số oxi hóa vừa tăng vừa giảm sau phản ứng).
d)
Cl2 là chất oxi hoá (số oxi hóa giảm sau phản ứng).
Bài 17.19 trang 77 SBT Hóa học 10: Muối NaCl có lẫn một ít NaI. Nhận biết sự có mặt của muối NaI có trong hỗn hợp.
Lời giải:
Bước 1: Hoà tan mẫu muối vào nước, thêm vài giọt hồ tinh bột, hỗn hợp dung dịch không màu.
Bước 2: Nhỏ vài giọt nước chlorine vào hỗn hợp dung dịch trên, xuất hiện màu xanh đen.
Đặc trưng của iodine gặp hồ tinh bột, dung dịch có màu xanh đen.
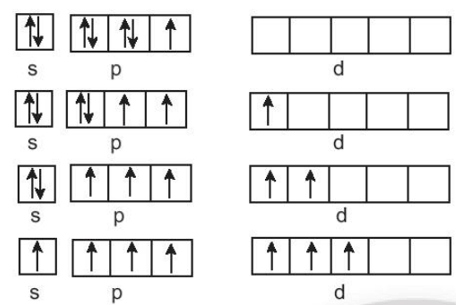
Bài 17.20 trang 77 SBT Hóa học 10: Trong hợp chất, số oxi hóa của halogen (trừ F) thường là – 1, + 1, + 3, + 5, + 7. Tại sao các số oxi hóa chẵn không đặc trưng đối với halogen trong hợp chất?
Lời giải:
Chlorine (Cl): 1s22s22p63s23p5
Bromine (Br): 1s22s22p63s23p63d104s24p5
Iodine (l): 1s22s22p63s23p63d104s24p64d105s25p5.
Cấu hình electron lớp ngoài cùng của nguyên tử halogen: ns2np5, có 1 electron không ghép đôi; chlorine, bromine, iodine tạo hợp chất có mức oxi hoá -1 khi liên kết với nguyên tử có độ âm điện nhỏ hơn như kim loại, hydrogen, ... và tạo mức oxi hoá +1 khi liên kết với nguyên tử có độ âm điện lớn hơn như oxygen, fluorine, ...
Ngoài ra, chlorine, bromine, iodine còn các ô lượng tử chưa lấp đầy, có thể xảy ra các quá trình kích thích electron lên phân mức năng lượng cao hơn, tạo ra mức oxi hoá +3, +5, +7. Vì vậy, các số oxi hoá chẵn không đặc trưng đối với halogen trong hợp chất.
Bài 17.21 trang 77 SBT Hóa học 10: Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hóa – 1, còn các nguyên tố chlorine, bromine, iodine là – 1, + 1, + 3, + 5, + 7?
Lời giải:
Cấu hình electron lớp ngoài cùng của nguyên tử halogen ns2np5, có 1 electron không ghép đôi; chlorine, bromine, iodine tạo hợp chất có mức oxi hoá -1 khi liên kết với nguyên tử có độ âm điện nhỏ hơn như kim loại, hydrogen, ... và tạo mức oxi hoá +1 khi liên kết với nguyên tử có độ âm điện lớn hơn như oxygen, fluorine, ...
Ngoài ra, chlorine, bromine, iodine còn các ô lượng tử chưa lấp đầy, có thể xảy ra các quá trình kích thích electron lên phân mức năng lượng cao hơn, tạo ra mức oxi hoá +3, +5, +7.
Cấu hình elecron của fluorine là 1s22s22p5, ở lớp elecron ngoài cùng có 1 electron không ghép đôi, không có ô lượng tử trống, khi hình thành liên kết hoá học, không có nguyên tử nào có độ âm điện lớn hơn fluorine đủ để cung cấp năng lượng cho quá trình kích thích, vì vậy, fluorine chỉ thể hiện mức oxi hoá -1 trong các hợp chất.
Bài 17.22 trang 77 SBT Hóa học 10: Tại sao đơn chất halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4)?
Lời giải:
Chất tan dễ dàng hoà tan trong dung môi có cùng bản chất: chất tan phân cực dễ tan trong dung môi phân cực và ngược lại. Đơn chất halogen là chất không phân cực nên dễ tan trong các dung môi không phân cực như hexane, carbon tetrachloride và ít tan trong dung môi phân cực như nước.
Bài 17.23 trang 77 SBT Hóa học 10: Tại sao chỉ có tên gọi nước chlorine, bromine, iodine nhưng không có nước fluorine?
Lời giải:
Dựa trên kết quả thực nghiệm về độ hoà tan của các halogen trong nước ở 25°C, fluorine phản ứng mãnh liệt với nước theo phương trình:
2F2 + 2H2O → 4HF + O2 nên không tổn tại nước fluorine.
Các halogen còn lại tác dụng chậm và tan một phần trong nước tạo thành nước halogen tương ứng.
Bài 17.24 trang 77 SBT Hóa học 10: Một học sinh thực hiện thí nghiệm và cho kết quả như sau:
Bước 1: Lấy 2 mL dung dịch NaBr vào ống nghiệm, dung dịch không màu.
Bước 2: Lấy tiếp 1 mL hexane vào ống nghiệm, lắc mạnh để quan sát khả năng hòa tan của 2 chất lỏng. Nhận thấy 2 chất lỏng không tan vào nhau và phân tách lớp.
Bước 3: Thêm 1 mL nước Cl2 vào ống nghiệm, lắc đều rồi để yên. Quan sát thấy lớp chất lỏng phía trên có màu da cam.
Viết phương trình hóa học của phản ứng. Thí nghiệm trên chứng minh tính chất vật lí và hóa học nào của halogen tương ứng?
Lời giải:
Phương trình hoá học của phản ứng:
Cl2 + 2NaBr → 2NaCl + Br2
Bước 1: NaBr là hợp chất ion, phân tử phân cực mạnh nên tan tốt trong nước, dung dịch đồng nhất, không màu.
Bước 2: Hexane là chất hữu cơ không phân cực, hỗn hợp dung dịch muối NaBr và hexane không tan vào nhau, hexane nhẹ hơn nên phân lớp phía trên.
Bước 3: Br2 được tạo ra dễ tan trong hexane, lớp chất lỏng phía trên có màu da cam.
Thí nghiệm chứng minh tính tan của đơn chất halogen trong 2 loại dung môi và chứng minh tính oxi hoá của Cl2 mạnh hơn Br2
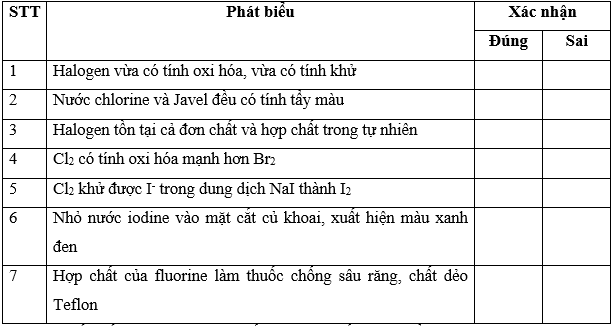
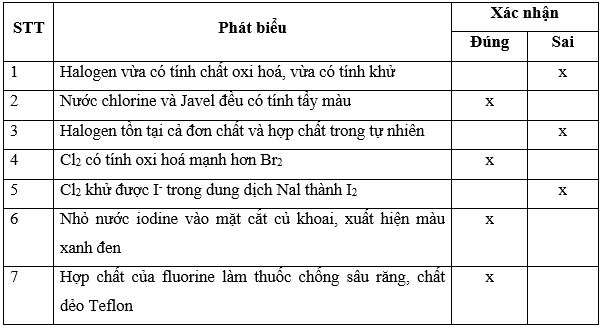
Bài 17.25 trang 77 SBT Hóa học 10: Xác nhận đúng, sai cho các phát biểu trong bảng sau:
Lời giải:
Lời giải SBT Hóa 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA hay khác:
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
SBT Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
SBT Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
SBT Hóa 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

