Giải SBT Hóa học 10 trang 35 Kết nối tri thức
Với Giải SBT Hóa học 10 trang 35 trong Bài 13: Liên kết hydrogen và tương tác van der Waals Sách bài tập Hóa 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 35.
Giải SBT Hóa học 10 trang 35 Kết nối tri thức
Bài 13.9 trang 35 SBT Hóa học 10: Cho các khí hiếm sau: He, Ne, Ar, Kr, Xe
Khí hiếm có nhiệt độ nóng chảy thấp nhất và cao nhất lần lượt là
A. Xe và He
B. Ar và Ne
C. He và Xe
D. He và Kr
Lời giải:
Đáp án đúng là: C
Chú ý:
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
- Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA, bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng.
⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy và nhiệt độ sôi tăng.
⇒ Khí hiếm có nhiệt độ nóng chảy thấp nhất là He và cao nhất là Xe.
Bài 13.10 trang 35 SBT Hóa học 10: Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH
Số chất tạo được liên kết hydrogen là
A. 2
B. 3
C. 4
D. 5
Lời giải:
Đáp án đúng là: B
Các chất tạo được liên kết hydrogen là: H2O, NH3, C2H5OH
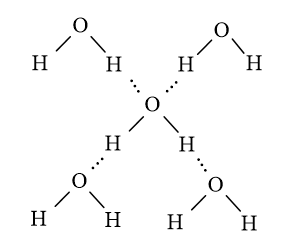
- Phân tử nước có hai nguyên tử H liên kết với nguyên tử O (có độ âm điện lớn) nên mỗi nguyên tử H trong phân tử nước này có thể tạo liên kết hydrogen với nguyên tử O trong phân tử nước khác. Bên cạnh đó, nguyên tử O còn 2 cặp electron chưa liên kết nên có thể tạo 2 liên kết hydrogen với nguyên tử H trong 2 phân tử nước khác.
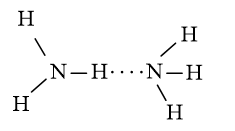
- Nguyên tử N có độ âm điện lớn làm cho liên kết N-H phân cực mạnh, trong phân tử NH3 nguyên tử N còn cặp electron chưa liên kết nên có thể tạo liên kết hydrogen giữa các phân tử NH3 với nhau.
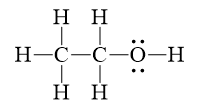
- Nguyên tử H gắn với nguyên tử O có độ âm điện cao nên H đó linh động, có thể tham gia tạo liên kết với O trong phân tử C2H5OH khác.
- C có độ âm điện nhỏ nên liên kết C-H phân cực yếu, nguyên tử C không còn cặp electron chưa liên kết nên không có khả năng tạo liên kết hydrogen giữa các phân tử CH4 với nhau
- PF3 không tạo được liên kết hydrogen vì không có nguyên tử H linh động.
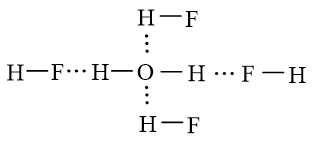
Bài 13.11 trang 35 SBT Hóa học 10: Giữa H2O và HF có thể tạo ra ít nhất bao nhiêu liên kết hydrogen?
A. 2
B. 3
C. 4
D. 5
Lời giải:
Đáp án đúng là: C
Một phân tử nước có thể tạo được 4 liên kết hydrogen với 4 phân tử HF.
Bài 13.12 trang 35 SBT Hóa học 10: Nhiệt độ sôi của từng chất methane, ethane, propane và butane là một trong bốn nhiệt độ sau: 0oC; -164oC; -42oC và -88oC.
Nhiệt độ sôi -88oC là của chất nào sau đây?
A. methane
B. propane
C. ethane
D. butane
Lời giải:
Đáp án đúng là: C
Methane: CH4
Ethane: C2H6
Propane: C3H8
Butane: C4H10
Theo dãy từ methane đến butane khối lượng phân tử tăng dần ⇒ Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần
Sắp xếp nhiệt độ sôi của từng chất tương ứng là:
|
Methane (CH4) |
Ethane (C2H6) |
Propane (C3H8) |
Butane (C4H10) |
|
-164oC |
-88oC |
-42oC |
0oC |
Bài 13.13 trang 35 SBT Hóa học 10: Cho các chất sau: C2H6; CH3OH; CH3COOH
Chất nào có thể tạo được liên kết hydrogen? Vì sao?
Lời giải:
CH3OH và CH3COOH chứa nguyên tử O có độ âm điện lớn (3,44) và nguyên tử H liên kết với nguyên tử O trong nhóm –OH là nguyên tử hydrogen linh động tạo ra liên kết hydrogen:
Bài 13.14 trang 35 SBT Hóa học 10: Khối lượng mol (g/mol) của nước, ammonia và methane lần lượt bằng 18, 17 và 16. Nước sôi ở 100oC, còn ammonia sôi ở -33,35oC và methane sôi ở -161,58oC. Giải thích vì sao các chất trên có khối lượng mol xấp xỉ nhau nhưng nhiệt độ sôi của chúng lại chênh lệch nhau.
Lời giải:
Nhiệt độ sôi của H2O lớn hơn rất nhiều so với NH3 và CH4 vì phân tử H2O và NH3 có liên kết hydrogen liên phân tử (còn CH4 không có), do độ âm điện O > N nên liên kết hydrogen trong H2O bền hơn trong NH3.
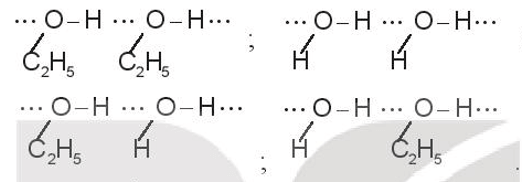
Bài 13.15 trang 35 SBT Hóa học 10: Trong dung dịch ethanol (C2H5OH) có những kiểu liên kết hydrogen nào? Kiểu nào bền nhất và kém bền nhất? Mô tả bằng hình vẽ.
Lời giải:
Dung dịch ethanol có C2H5OH và H2O, cả hai phân tử này đều chứa nguyên tử O có độ âm điện lớn (3,44) và nguyên tử H liên kết với nguyên tử O trong nhóm –OH là nguyên tử hydrogen linh động tạo ra liên kết hydrogen.
Có bốn kiểu liên kết hydrogen trong dung dịch ethanol: alcohol – alcohol; nước – nước; alcohol – nước và nước alcohol.
Liên kết hydrogen càng bền khi nguyên tử có độ âm điện lớn hơn và nguyên tử H linh động hơn. Trong bốn kiểu trên: kiểu bền nhất là liên kết giữa H của nước với O của alcohol (nước-alcohol). Kiểu kém bền nhất là liên kết giữa H của alcohol với O của alcohol (alcohol – alcohol).
Bài 13.16 trang 35 SBT Hóa học 10: Trong phân tử nước và ammonia, phân tử nào có thể tạo nhiều liên kết hydrogen hơn? Vì sao?
Lời giải:
– Số liên kết hydrogen trung bình được tạo thành trên mỗi phân tử phụ thuộc vào:
+ Số nguyên tử hydrogen liên kết với F, O hoặc N trong phân tử.
+ Số lượng các cặp electron chưa liên kết có mặt trên F, O, N
- Một phân tử nước có hai nguyên tử hydrogen và hai cặp electron chưa liên kết nên phân tử nước có nhiều liên kết hydrogen với các phân tử nước khác. Nó có mức trung bình là hai liên kết hydrogen trên mỗi phân tử.
- Ammonia có ít liên kết hydrogen hơn nước. Trung bình nó có thể hình thành chỉ một liên kết hydrogen trên mỗi phân tử. Mặc dù phân tử ammonia có ba nguyên tử hydrogen gắn với nguyên tử nitrogen, nhưng nó chỉ có một cặp electron duy nhất có thể tham gia vào quá trình hình thành liên kết hydrogen.
Bài 13.17 trang 35 SBT Hóa học 10: Dầu mỏ chứa hỗn hợp nhiều hydrogen như: octane (C8H18) có trong xăng; butane (C4H10) có trong gas. Khi chưng cất dầu mỏ, octane hay butane sẽ bay hơi nước? Giải thích.
Lời giải:
Khi chưng cất dầu mỏ, butane sẽ bay hơi trước octane. Vì octane (M = 114) có phân tử khối lớn hơn butane (M = 58) nên có nhiệt độ sôi cao hơn.
Bài 13.18 trang 35 SBT Hóa học 10: Cho các chất và các trị số nhiệt độ sôi (oC) sau:
H2O, H2S, H2Se, H2Te và -42; -2; 100; -61.
Ghép các trị số nhiệt độ sôi vào mỗi chất sao cho phù hợp và giải thích.
Lời giải:
- Giá trị nhiệt độ sôi của từng chất:
H2O (100oC); H2S (-61oC); H2Se (-42oC) và H2Te (-2oC).
- Giải thích: sự tăng nhiệt độ sôi từ H2S đến H2Te là do khối lượng phân tử tăng lên. Nếu H2O chỉ có lực van der Waals giữa các phân tử thì nhiệt độ sôi của nó dự đoán vào khoảng -80oC. Tuy nhiên, nhiệt độ sôi của H2O là 100oC, cao hơn nhiều, đó là vì phân tử H2O còn có liên kết hydrogen liên phân tử, làm cho liên kết giữa các phân tử H2O bền hơn.
Lời giải SBT Hóa 10 Bài 13: Liên kết hydrogen và tương tác van der Waals hay khác:
Xem thêm lời giải Sách bài tập Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
- SBT Hóa 10 Bài 14: Ôn tập chương 3
- SBT Hóa 10 Bài 15: Phản ứng oxi hóa - khử
- SBT Hóa 10 Bài 16: Ôn tập chương 4
- SBT Hóa 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
- SBT Hóa 10 Bài 18: Ôn tập chương 5
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT

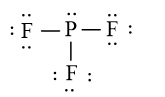



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

