7 bài tập trắc nghiệm Hợp kim (có đáp án)
Với 7 bài tập & câu hỏi trắc nghiệm Hợp kim lớp 12 có đáp án và lời giải chi tiết đầy đủ các mức độ nhận biết, thông hiểu, vận dụng sẽ giúp học sinh ôn luyện trắc nghiệm Hóa học 12.
7 bài tập trắc nghiệm Hợp kim (có đáp án)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Câu 1: Liên kết hoá học chủ yếu trong họp kim là
A. liên kết kim loại và liên kết cộng hoá trị.
B. liên kết cộng hoá trị và liên kết ion.
C. liên kết ion và tương tác yếu giữa các phân tử (tương tác Van der Waals).
D. tương tác yếu giữa các phân tử (tương tác Van der Waals) và liên kết kim loại.
Đáp án: A
Câu 2: Cho các tính chất sau :
( 1 ) Tính chất vật lí ; (2) Tính chất hoá học ; (3) Tính chất cơ học.
Hợp kim và các kim loại thành phần tạo hợp kim đỏ có tính chất nào tương tự ?
A. (1) B. (2) và (3) C. (2) D.(l)và(3)
Đáp án: C
Câu 3: Có các phát biểu sau:
(1) Hợp kim thép (Fe-C) ít bị ăn mòn hơn sắt.
(2) Hợp kim Al-Cu-Mn-Mg nhẹ và cứng, dùng trong chế tạo tên lửa, tàu vũ trụ.
(3) Hợp kim vàng tây (Au-Ag-Cu) cứng hơn vàng nguyên chất.
(4) Hợp kim Bi-Pb-Sn có nhiệt độ nóng chảy rất cao.
Trong các phát biểu trên, số phát biểu đúng là
A.l. B. 2. C.3. D. 4.
Đáp án: B
Các phát biểu đúng: (2) và (3)
Câu 4: Một mẫu kim loại thủy ngân có lẫn tạp chất kẽm, thiếc, chì. Để làm sạch các tạp chất này có thể cho mẫu thủy ngân trên tác dụng với lượng dư của dung dịch nào sau đây ?
A. Hg(NO3)2 B. Zn(NO3)2 C. Sn(NO3)2 D. Pb(NO3)2
Đáp án: A
Khi cho mẫu thuỷ ngân lẫn các tạp chất kém, thiếc, chì phản ứng với Hg(HNO3)2 dư sẽ xảy ra các phản ứng:
Zn + Hg(NO3)2 → Zn(NO3)2 + Hg
Sn + Hg(NO3)2 → Sn(NO3)2 + Hg
Pb + Hg(NO3)2 → Pb(NO3)2 + Hg
Vậy toàn bộ các tạp chất được loại bỏ khỏi Hg
Câu 5: Có 3 mẫu họp kim gồm Ag-Cu, Cu-Al và Fe-Cr-Mn. Dùng dung dịch nào sau đây có thể phân biệt được 3 hợp kim trên ?
A. HNO3 B. HCl
C. AgNO3 D. H2SO4đặc, nóng
Đáp án: D
Câu 6: Để xác định hàm lượng C trong một mẫu hợp kim Fe-C, người ta đem nung m gam hợp kim này trong không khí. Sau phản ứng hoàn toàn, chất rắn thu được có khối lượng tăng 28,89% so với lượng chất rắn ban đầu
a) Công thức hoá học của loại hợp kim trên là
A. FeC. B. FeC2. C. FeC3. D. Fe3C.
b) Hàm lượng % của C trong hợp kim trên là
A. 17,65. B. 30,00%. C. 39,13%. D. 6,67%.
Đáp án: a/ D, b/ D
đặt số mol Fe và C trong hợp kim lần lượt là x và y.
Vậy m = 56x + 12y
Phản ứng xảy ra khi nung hợp kim này trong không khí:
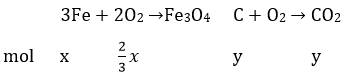
Sau phản ứng có 2x/3 mol O2 thêm vào và y mol C tách ra khỏi chất rắn
Khối lượng tăng thêm là:
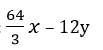
Theo đề ta có:
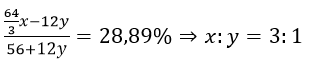
Vậy công thức hợp kim là Fe3C và hàm lượng C là 6,67%
Câu 7: Một hợp kim có chứa 2,8 gam Fe và 0,81 gam Al. Cho hợp kim vào 200ml dung dịch X chứa AgNO3 và Cu(NO3)2 sau khi phản ứng kết thúc được dung dịch Y và 8,12 gam chất rắn Z gồm 3 kim loại. Cho chất rắn Z tác dụng với dung dịch HCl dư được 0,672 lít H2 (ở đktc). Nồng độ mol của dung dịch AgNO3 là:
A. 0,1 B. 0,15 C. 0,28 D. 0,25
Đáp án: B
Z gồm 3 kim loại Ag, Cu và Fe dư
Đặt số mol Ag, Cu và Fe trong Z lần lượt là a, b, c
mhỗn hợp = 108a + 64b + 56c = 8,12 (1)
khi cho Z tác dụng với HCl, chỉ có Fe phản ứng tạo khí
Fe + HCl → FeCl2 + H2
nFe = nH2 = 0,03 mol, hay c = 0,03 mol (2)
xét phản ứng của 2,8 gam Fe ( 0,05 mol) và 0,81 gam Al ( 0,03 mol) với dung dịch X.
Sau phản ứng này Fe còn dư ( 0,03 mol) nên toàn bộ Al đã phửn ứng hết


Bảo toàn e: a + 2b = 0,13 (3)
Từ (1), (2) và (3), suy ra: a = 0,03 mol; b = 0,05 mol; c = 0,03 mol
CM(AgNO3) = 0,15M
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Bài tập & Câu hỏi trắc nghiệm Hóa học 12 có đáp án khác:
- 15 bài tập trắc nghiệm Sự ăn mòn kim loại (có đáp án)
- 15 bài tập trắc nghiệm Điều chế kim loại (có đáp án)
- 15 bài tập trắc nghiệm Tính chất của kim loại (có đáp án)
- 15 bài tập trắc nghiệm Điều chế kim loại và sự ăn mòn kim loại (có đáp án)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

