Trình bày cách pha chế một dung dịch theo nồng độ cho trước
Trình bày cách pha chế một dung dịch theo nồng độ cho trước
Câu hỏi : Trình bày cách pha chế một dung dịch theo nồng độ cho trước?
Trả lời:
Để pha chế một dung dịch theo nồng độ cho trước, ta thực hiện theo hai bước sau:
Bước 1. Tính các đại lượng cần dùng.
Bước 2. Pha chế dung dịch theo các đại lượng đã xác định.
a) Pha chế dung dịch theo nồng độ mol/l (CM) cho trước:
Từ muối A, nước cất và các dụng cụ cần thiết. Hãy pha chế V ml dung dịch A nồng độ CM.
+ Bước 1. Tính số mol chất tan có trong dung dịch cần pha theo công thức:
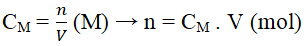
+ Bước 2. Từ số mol suy ra khối lượng chất tan A (m) cần lấy để pha chế.
+Bước 3. Tính thể tích nước cần dùng để pha chế.
Vậy cần lấy m gam chất tan A hòa tan vào V ml nước cất để tạo thành V ml dung dịch A có nồng độ CM.
Ví dụ: Từ muối NaCl, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế: 100 ml dung dịch NaCl 1M.
Hướng dẫn:
Bước 1: Tính toán:
- Số mol chất tan NaCl là:
nNaCl = 1.0,1 = 0,1 (mol)
- Khối lượng của NaCl cần lấy là:
mNaCl = nNaCl . MNaCl = 0,1.58,5 = 5,85 (g)
Bước 2: Cách pha chế dung dịch:
- Cân 5,85 g NaCl khan cho vào một cốc thủy tinh loại 200 ml.
- Cho từ từ nước cất vào cốc và khuấy nhẹ cho đủ 100 ml dung dịch.
- Ta được dung dịch NaCl 1M.
b) Pha chế dung dịch theo nồng độ phần trăm (C%) cho trước
Từ muối B, nước cất và các dụng cụ cần thiết, hãy pha chế m gam dung dịch B có nồng độ C%.
+ Bước 1. Tính khối lượng chất tan cần pha chế:

Bước 2. Tính khối lượng nước cần pha chế
mdd = mdm + mct → m2 = mdm = mdd – mct
Vậy cần lấy m1 gam chất B hòa tan vào m2 gam nước để thu được m gam dung dịch B có nồng độ C%.
Ví dụ: Từ muối NaCl, nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế: 50 g dung dịch NaCl 15%.
Hướng dẫn:
Bước 1: Tính toán:
- Khối lượng chất tan NaCl là:
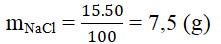
- Khối lượng của dung môi (nước) là:
mdm = mdd – mct = 50 -7,5 = 42,5 (g)
Bước 2: Cách pha chế dung dịch:
- Cân 7,5 g NaCl khan cho vào một cốc thủy tinh loại 100 ml.
- Cân 42,5 g nước cất (hoặc 42,5 ml) cho vào cốc.
- Khuấy nhẹ cho NaCl tan hoàn toàn, ta được dung dịch NaCl 15%.
Xem thêm các câu hỏi thường gặp môn Hóa học lớp 8 hay và chi tiết khác:
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

