Bài 38.1, 38.2, 38.3, 38.4, 38.5, 38.6 trang 93 SBT Hóa học 12
Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng
Bài 38.1 trang 93 Sách bài tập Hóa học 12: Để phân biệt dung dịch H2S04 đặc, nguội và dung dịch HNO3 đặc, nguội có thể dùng kim loại nào sau đây ?
A. Cr. B. Al C. Fe. D. Cu.
Lời giải:
D
Bài 38.2 trang 93 Sách bài tập Hóa học 12: Có hai dung dịch axit là HCl và HNO3 đặc, nguội. Kim loại nào sau đây có thể dùng để nhận biết hai dung dịch axịt trên ?
A. Fe B. Al C. Cr D. Cu
Lời giải:
D
Bài 38.3 trang 93 Sách bài tập Hóa học 12: Cho kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit kim loại Y. X và Y có thể là
A. đồng và sắt. B. sắt và đồng.
C. đồng và bạc. D. bạc và đồng.
Lời giải:
B
Bài 38.4 trang 93 Sách bài tập Hóa học 12: Cho 9,14 g hợp kim Cu, Mg và Al tác dụng với dung dịch HCl dư thu được khí X và 2,54 g chất rắn Y. Trong hợp kim, khối lượng Al gấp 4,5 lần khối lượng Mg. Thể tích khí X (đktc) là
A. 7,84 lít. B. 5,6 lít C. 5,8 lít D. 6,2 lít.
Lời giải:
A
2,54g c/rắn Y là Cu ⟹ mAl + mMg = 9,14 – 2,54 = 6,6g
Ta có: mAl = 4,5mMg
⟹ mAl = 5,4g; nMg = 1,2g
Ta có: nH2 = 3/2 nAl + nMg = 0,3 + 0,05 = 0,35 mol
⟹ VX = 7,84 lít
Bài 38.5 trang 93 Sách bài tập Hóa học 12: Cho 19,2 g Cu vào dung dịch loãng chứa 0,4 mol HNO3, phản ứng xảy ra hoàn toàn thì thể tích khí NO (đktc) thu được là
A. 1,12 lít B. 2,24 lít. C. 4,48 lít. D. 3,36 lít.
Lời giải:
B
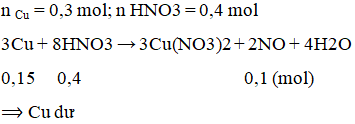
Bài 38.6 trang 94 Sách bài tập Hóa học 12: Điện phân 200ml dung dịch CuCl2 sau một thời gian người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm một đinh sắt sạch trong dung dịch còn lại sau khi điện phân phản ứng xong thấy khối lượng đinh sắt tăng 1,2g. Nồng độ mol ban đầu của dung dịch CuCl2 là
A. 0,25M B. 1,5M C. 1,0M D. 0,75M
Lời giải:
C
Ta có: nCl2 = 0,05 mol
⟹ nCuCl2 = 0,05 mol
Vì sau phản ứng ngâm đinh sắt sạch trong dung dịch thấy khối lượng đinh sắt tăng lên ⟹ Cu2+ dư
Cu2+ + Fe → Cu + Fe2+
1 mol Cu2+ tham gia phản ứng làm cho thanh sắt tăng: 64 – 56g = 8g
Khối lượng thanh sắt tăng 1,2g ⟹ nCu2+ = 1,2.1/8 = 0,15 mol
⟹ nCuCl2 = 0,05 + 0,15 = 0,2 mol
CM CuCl2 = 0,2 : 0,2 = 1M
Các bài giải sách bài tập Hóa học 12 (SBT Hóa học 12) khác:
- Bài 38.1, 38.2, 38.3, 38.4, 38.5, 38.6 trang 93 Sách bài tập Hóa học 12: Để phân biệt dung dịch ....
- Bài 38.7 trang 94 Sách bài tập Hóa học 12: Viết PTHH hoàn thành ....
- Bài 38.8 trang 94 Sách bài tập Hóa học 12: Cho 3,2 gam bột ....
- Bài 38.9 trang 94 Sách bài tập Hóa học 12: Tính thể tích của ....
- Bài 38.10 trang 94 Sách bài tập Hóa học 12: So sánh tính chất ....
- Bài 38.11 trang 94 Sách bài tập Hóa học 12: Viết phương trình hóa học ....
- Bài 38.12 trang 94 Sách bài tập Hóa học 12: Amoni đicromat khi được ....
- Bài 38.13 trang 94 Sách bài tập Hóa học 12: Cho 41,4g hỗn hợp ....
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

