Giải Hóa học 10 trang 76 Cánh diều
Với Giải Hóa học 10 trang 76 trong Bài 13: Phản ứng oxi hóa – khử Hóa học 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 76.
Giải Hóa học 10 trang 76 Cánh diều
Bài 1 trang 76 Hóa học 10: Xác định số oxi hóa của mỗi nguyên tử trong phân tử và ion sau đây:
a) H2SO3
b) Al(OH)4-
c) NaAlH4
d) NO2-
Lời giải:
a) H2SO3
Theo quy tắc 1: Số oxi hóa của O là -2, H là +1
Theo quy tắc 2: Gọi số oxi hóa của S là x ta có:
2.(+1) + 1.x + 3.(-2) = 0 → x = +4
Vậy trong H2SO3 số oxi hóa của O là -2, H là +1, S là +4
b) Al(OH)4-
Theo quy tắc 1: Số oxi hóa của O là -2, H là +1, Al là +3
Theo quy tắc 2:
1.(+3) + 4.(-2) + 4.(+1) = -1 (Thỏa mãn)
Vậy trong Al(OH)4- số oxi hóa của O là -2, H là +1, Al là +3.
c) NaAlH4
Theo quy tắc 1: Số oxi hóa của Na là +1, Al là +3
Theo quy tắc 2: Gọi số oxi hóa của H là x ta có:
1.(+1) + 1.(+3) + 4.x = 0 → x = -1
Vậy trong NaAlH4 số oxi hóa của Na là +1, H là -1, Al là +3.
d) NO2-
Theo quy tắc 1: Số oxi hóa của O là -2
Theo quy tắc 2: Gọi số oxi hóa của N là x ta có:
1.x + 2.(-2) = -1 → x = +3
Vậy trong NO2- số oxi hóa của N là +3, O là -2.
Bài 2 trang 76 Hóa học 10: Xác định chất oxi hóa, chất khử, viết quá trình oxi hóa, quá trình khử trong các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+
c) 2As + 3Cl2 → 2AsCl3
d*) Al + 6H+ + 3NO3- → Al3+ + 3NO2 + 3H2O
Lời giải:
a) Ag+ + Fe2+ → Ag + Fe3+
Chất oxi hóa: Ag+
Chất khử: Fe2+
Quá trình khử:
Quá trình oxi hóa:
b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+
Chất oxi hóa: Hg2+
Chất khử: Fe
Quá trình khử:
Quá trình oxi hóa:
c) 2As + 3Cl2 → 2AsCl3
Chất oxi hóa: Cl2
Chất khử: As
Quá trình khử:
Quá trình oxi hóa:
d*) Al + 6H+ + 3NO3- → Al3+ + 3NO2 + 3H2O
Chất khử: Al
Chất oxi hóa: NO3-
Quá trình khử:
Quá trình oxi hóa:
Bài 3 trang 76 Hóa học 10: Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron:
a) NaBr + Cl2 → NaCl + Br2
b) Fe2O3 + CO → Fe + CO2
c) CO + I2O5 → CO2 + I2
d) Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O
e) H+ + MnO4- + HCOOH → Mn2+ + H2O + CO2
Lời giải:
a) NaBr + Cl2 → NaCl + Br2
⇒
2NaBr + Cl2 → 2NaCl + Br2
b) Fe2O3 + CO → Fe + CO2
⇒
Fe2O3 + 3CO → 2Fe + 3CO2
c) CO + I2O5 → CO2 + I2
⇒
5CO + I2O5 → 5CO2 + I2
d) Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O
⇒
2Cr(OH)3 + 3Br2 + 10OH- → 2CrO42- + 6Br- + 8H2O
e) H+ + MnO4- + HCOOH → Mn2+ + H2O + CO2
⇒
6H+ + 2MnO4- + 5HCOOH → 2Mn2+ + 8H2O + 5CO2
Bài 4 trang 76 Hóa học 10: Nước oxi già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2).
a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử.
b) Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2. Viết quá trình khử minh họa cho nguyên tử nguyên tố đó.
Lời giải:
a) H2O2 có công thức cấu tạo là: H – O – O – H
Xét liên hết O – O, hai nguyên tử O có độ âm điện bằng nhau nên electron không bị lệch về phía nguyên tử nào.
Xét mỗi liên kết O – H, O góp 1 electron, khi giả định H2O2 là hợp chất ion thì 1 electron này chuyển sang O (O có độ âm điện lớn hơn H).
H2O2 có công thức ion giả định là: H1+O1-O1-H1+
Vậy số oxi hóa của O là -1, H là +1
b) Ngoài số oxi hóa là -1 trong H2O2, trong các hợp chất khác số oxi hóa của O thường là -2. Khi H2O2 tham gia phản ứng oxi hóa – khử, số oxi hóa của O giảm từ -1 xuống -2
⇒ H2O2 là chất oxi hóa (chất bị khử hoặc có tính oxi hóa).
Quá trình khử:
Vậy nguyên tử O gây nên tính oxi hóa của H2O2
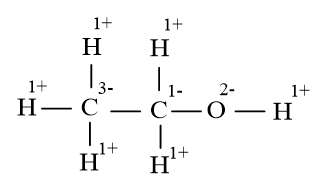
Bài 5 trang 76 Hóa học 10: Xăng E5 được tạo nên bởi sự pha trộn xăng A92 và ethanol (C2H5OH) theo tỉ lệ thể tích tương ứng là 95 : 5, giúp thay thế một phần nhiên liệu hóa thạch, phù hợp với xu thế phát triển chung trên thế giới và góp phần đảm bảo an ninh năng lượng quốc gia.
Viết phương trình của phản ứng hóa học đốt cháy ethanol thành CO2 và H2O. Phản ứng này có phải là phản ứng oxi hóa – khử hay không? Nó thuộc loại phản ứng cung cấp hay tích trữ năng lượng.
Lời giải:
C2H5OH + 3O2 2CO2 + 3H2O
Cách 1: Xác định số oxi hóa trung bình của C trong hợp chất C2H5OH
Số oxi hóa của O là -2, H là +1
Gọi số oxi hóa trung bình của C là x ta có:
2.x + 5.(+1) + 1.(-2) + 1.(+1) = 0 → x = -2
Vậy số oxi hóa trung bình của C trong C2H5OH là +2
Ta thấy có sự thay đổi số oxi hóa của C và O trước và sau phản ứng
⇒ Là phản ứng oxi hóa khử
Cách 2: Xác định số oxi hóa cụ thể của từng nguyên tử C trong hợp chất C2H5OH
- Dựa theo công thức cấu tạo
Giả định C2H5OH là hợp chất ion:
- Dựa theo số oxi hóa của một số nguyên tử đã biết
Trong hợp chất hữu cơ số oxi hóa của H, O, kim loại nhóm IA, IIA vẫn tuân theo quy tắc 1 (H là +1, O là -2,…)
Ta có thể tách riêng từng nhóm ra tính. Trong hợp chất C2H5OH (hoặc CH3CH2OH) tách thành CH3 và CH2OH, số oxi hóa của các nhóm này bằng 0.
Do đó trong , C có số oxi hóa -3; trong , C có số oxi hóa -1
Ta thấy có sự thay đổi số oxi hóa của C và O trước và sau phản ứng
⇒ Là phản ứng oxi hóa khử
Phản ứng này thuộc loại phản ứng cung cấp năng lượng.
Lời giải bài tập Hóa học 10 Bài 13: Phản ứng oxi hóa – khử hay khác:
- Giải Hóa học 10 trang 71
- Giải Hóa học 10 trang 72
- Giải Hóa học 10 trang 73
- Giải Hóa học 10 trang 74
- Giải Hóa học 10 trang 75
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

