Hệ thống hóa kiến thức Hóa 10 Kết nối tri thức Chương 7
Với Hệ thống hóa kiến thức Hóa 10 Chương 7: Nguyên tố nhóm halogen sách Kết nối tri thức hay nhất, chi tiết sẽ tóm tắt lý thuyết trọng tâm Hóa học 10 Chương 7 để giúp học sinh học tốt môn Hóa học 10.
Hệ thống hóa kiến thức Hóa 10 Kết nối tri thức Chương 7
(199k) Xem Khóa học Hóa 10 KNTT
Hệ thống hóa kiến thức:
- Nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học còn gọi là nhóm halogen, gồm 6 nguyên tố: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts). Bốn nguyên tố F, Cl, Br, I tồn tại trong tự nhiên; còn At và Ts là các nguyên tố phóng xạ.
1. Nguyên tử halogen
- Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất:
ns2np5 + 1e → ns2np6
- Số oxi hóa đặc trưng của các halogen trong hợp chất là -1.
- Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có số oxi hóa dương: +1; +3; +5; +7 (trừ fluorine có độ âm điện lớn nhất nên fluorine luôn có số oxi hóa bằng -1 trong mọi hợp chất).
2. Đơn chất halogen
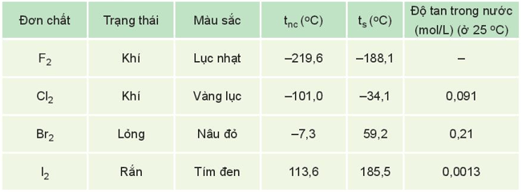
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
- Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
- Các phản ứng hóa học điều chế chlorine:
+ Cho quặng pyrolusite (MnO2) tác dụng với hydrochloric đặc:
MnO2 + 4HCl đặc MnCl2 + Cl2 + 2H2O
+ Có thể thay MnO2 bằng KMnO4 rắn để điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- Trong công nghiệp, chlorine được sản xuất ở nhiệt độ thường bằng cách điện phân dung dịch muối ăn bão hòa, có màng ngăn giữa các điện cực:
2NaCl + 2H2O 2NaOH + H2 + Cl2
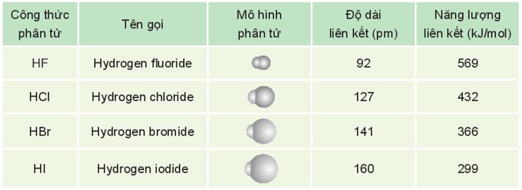
3. Hydrogen halide
- Phân tử hydrogen halide (HX) gồm một liên kết cộng hóa trị. Các phân tử HX là phân tử phân cực.
Hoặc H – X
- Một số đặc điểm của hydrogen halide được thể hiện trong bảng sau:
- Ở điều kiện thường, hydrogen halide tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic acid tương ứng.
4. Muối halide
- Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan, ví dụ như silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chloride, lead bromide.
- Phân biệt các ion F-; Cl-; Br-; I- trong dung dịch: dùng dung dịch silver nitrate
+ Khi ion là F- thì không thấy sự biến đổi, do không có phản ứng hóa học xảy ra.
+ Khi ion là Cl- thì xuất hiện kết tủa trắng silver chloride (AgCl).
+ Khi ion là Br- thì xuất hiện kết tủa màu vàng nhạt silver bromide (AgBr).
+ Khi ion là I- thì xuất hiện kết tủa màu vàng silver iodide (AgI).
- Phương trình hóa học minh họa:
NaCl + AgNO3 NaNO3 + AgCl ↓
NaBr + AgNO3 NaNO3 + AgBr ↓
NaI + AgNO3 NaNO3 + AgI ↓
- Tính khử của các ion halide tăng dần theo thứ tự: Cl- < Br- < I-
- Ví dụ:
+ Sodium bromide khử được sulfuric acid đặc thành sulfur đioxide:
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O
+ Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen sulfide:
8NaI + 9H2SO4 → 8NaHSO4 + 4I2 + H2S + 4H2O
+ Trong điều kiện như trên NaCl, chỉ xảy ra phản ứng trao đổi tạo thành hydrogen chloride.
(199k) Xem Khóa học Hóa 10 KNTT
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Kết nối tri thức hay khác:
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

