Lý thuyết Nitrogen (Hóa 11 Kết nối tri thức Bài 4)
Với tóm tắt lý thuyết Hóa 11 Bài 4: Nitrogen sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Nitrogen (Hóa 11 Kết nối tri thức Bài 4)
(199k) Xem Khóa học Hóa 11 KNTT
I. Trạng thái tự nhiên
Nguyên tố nitrogen tồn tại trong tự nhiên với 2 đồng vị bền là 14N (99,63%) và 15N (0,37%).
+ Trong khí quyển Trái Đất, nitrogen là nguyên tố phổ biến nhất, chiếm 75,5% khối lượng (hoặc 78,1% thể tích) và tập trung chủ yếu ở tầng đối lưu.
+ Trong vỏ Trái Đất, nguyên tố nitrogen tồn tại tập trung ở một số mỏ khoáng dưới dạng sodium nitrate (thường gọi là diêm tiêu Chile).
+ Nguyên tố nitrogen có trong tất cả cơ thể người, động vật và thực vật, là thành phần cấu tạo nên nucleic acid, protein, … Trong cơ thể người, nitrogen chiếm khoảng 3% khối lượng, đứng thứ tư sau oxygen, carbon và hydrogen.
II. Cấu tạo nguyên tử, phân tử
1. Cấu tạo nguyên tử
- Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn. Nguyên tử nitrogen có độ âm điện lớn (3,04). Nitrogen là phi kim điển hình.
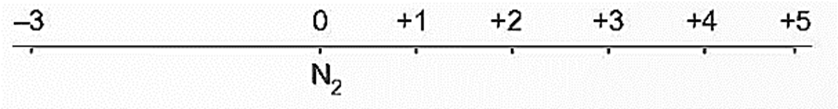
- Nitrogen tạo ra nhiều hợp chất với các số oxi hoá khác nhau từ ̶ 3 đến +5. Các số oxi hoá thường gặp của nitrogen được biểu diễn ở trục số oxi hoá dưới đây:
2. Cấu tạo phân tử
Phân tử nitrogen gồm 2 nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết σ và 2 liên kết π). Phân tử nitrogen có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
III. Tính chất vật lí
Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hoá lỏng (hoá lỏng ở -196 oC), tan rất ít trong nước (1 lít nước hoà tan được 0,012 lít khí nitrogen). Khí nitrogen không duy trì sự cháy và sự hô hấp.
Lưu trữ tế bào gốc trong nitrogen lỏng
IV. Tính chất hoá học
Ở nhiệt độ thường, nitrogen khá trơ; ở nhiệt độ cao, nitrogen trở lên hoạt động hơn. Nitrogen thể hiện cả tính oxi hoá và tính khử.
1. Tác dụng với hydrogen
Trong phản ứng này, nitrogen thể hiện tính oxi hoá.
Đây là quá trình quan trọng nhất để sản xuất ammonia, thường gọi là quá trình Haber – Bosch, quá trình này được thực hiện ở quy mô công nghiệp từ năm 1913.
Phản ứng tổng hợp ammonia là quá trình trung gian quan trọng để sản xuất nitric acid, thuốc nổ, đạm nitrate, urea, ammophos,…
2. Tác dụng với oxygen
- Ở nhiệt độ cao trên 3000oC hoặc có tia lửa điện, nitrogen kết hợp với oxygen, tạo ra nitrogen monoxide (NO) với hiệu suất rất thấp.
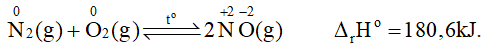
- Trong tự nhiên, phản ứng này xảy ra trong những cơn mưa giông kèm sấm sét, khởi đầu cho quá trình chuyển hoá từ nitrogen thành nitric acid. Nitric acid tan trong nước mưa và phân li ra ion nitrate là một dạng phân đạm mà cây trồng hấp thụ được để sinh trưởng, phát triển.
Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa được biểu diễn theo sơ đồ:
- Trong thực tế, phản ứng hoá hợp giữa nitrogen với oxygen thường xảy ra đồng thời với quá trình đốt cháy nhiên liệu ở nhiệt độ cao bằng không khí. Các hoạt động giao thông vận tải và sản xuất công nghiệp là nguyên nhân chính gây phát thải các oxide của nitrogen vào khí quyển.
V. Ứng dụng
Một số ứng dụng của nitrogen được thể hiện trong sơ đồ sau:
(199k) Xem Khóa học Hóa 11 KNTT
Xem thêm tóm tắt lý thuyết Hóa học lớp 11 Kết nối tri thức hay khác:
Xem thêm các tài liệu học tốt lớp 11 hay khác:
- Giải sgk Hóa học 11 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 11 Kết nối tri thức
- Giải SBT Hóa học 11 Kết nối tri thức
- Giải lớp 11 Kết nối tri thức (các môn học)
- Giải lớp 11 Chân trời sáng tạo (các môn học)
- Giải lớp 11 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT

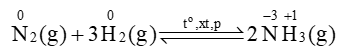
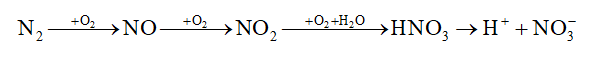




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

