Cách hoàn thành phản ứng hóa học Oxi, Lưu huỳnh (hay, chi tiết)
Bài viết Cách hoàn thành phản ứng hóa học Oxi, Lưu huỳnh với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách hoàn thành phản ứng hóa học Oxi, Lưu huỳnh.
Cách hoàn thành phản ứng hóa học Oxi, Lưu huỳnh (hay, chi tiết)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Cần nắm chắc các tính chất hóa học về oxi, ozon, lưu huỳnh, các hợp chất của chúng để thấy được mối quan hệ giữa các chất
- Với những bài ẩn tên chất yêu cầu tìm chất phù hợp và viết phương trình cần lựa chọn các chât tương ứng với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
Ví dụ minh họa
Ví dụ 1: Hãy viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của các nguyên tố lưu huỳnh theo sơ đồ sau:
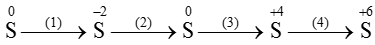
Lời giải:
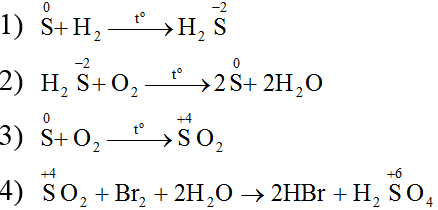
Ví dụ 2: Viết các phương trình phản ứng theo chuỗi biến hóa sau:
KClO3 → O2 → O3 → O2 → ZnO → ZnSO4
FeS → H2S → S → SO2 → CaSO3 → CaSO4
Lời giải:
a) 2KClO3
3O2
O3 + 2Ag → Ag2O + O2
O2 + 2Zn → 2ZnO
ZnO + H2SO4 → ZnSO4 + H2O
b) FeS + 2HCl → FeCl2 + H2S↑
2H2S + O2 thiếu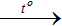
S + O2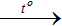
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + H2SO4 + SO2
Ví dụ 3: Hoàn thành sơ đồ biến hóa sau:
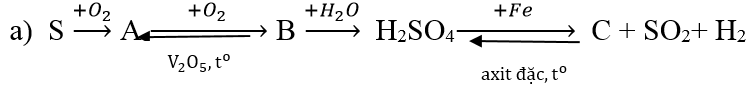
Lời giải:
S + O2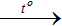
2SO2 + O2 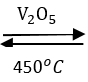
SO3 + H2O → H2SO4
6H2SO4 đặc + 2Fe 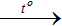
S + H2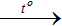
S + O2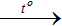
S + Fe 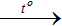
2H2S + SO2 → 3S + 2H2O
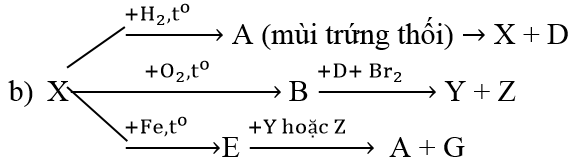
(X)⇒ S, (D) ⇒ H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(Y) ⇒ HBr, (Z) ⇒ H2SO4
FeS + 2HBr → FeBr2 + H2S↑
(G) ⇒ FeBr2 (A) ⇒ H2S
Hoặc FeS + H2SO4 → FeSO4+ H2S↑
(G)⇒ FeSO4 (A) ⇒ H2S
Ví dụ 4: Hoàn thành chuỗi các phản ứng sau, ghi rõ điều kiện nếu có:
ZnS → H2S → S → SO2 → SO3 → H2SO4 → HCl → Cl2 → KClO3 → O2
ZnS + 2HCl → ZnCl2 + H2S
2H2S + O2 thiếu → 2S + 2H2O
S + O2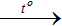
2SO2 + O2 
SO3+ H2O → H2SO4
H2SO4 đặc + NaCl tinh thể → NaHSO4 + HCl
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
3Cl2 + 6KHO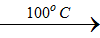
2KClO3 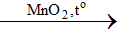
Ví dụ 5. Viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của nguyên tố lưu huỳnh theo sơ đồ sau:
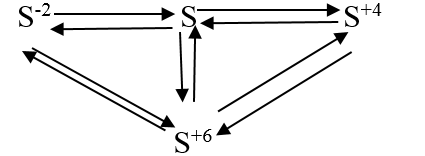
Lời giải:
+) S-2 → S0: 2H2S + O2 thiếu → 2S + 2H2O
+) S0 → S-2: H2 + S 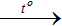
+) S0 → S+4: S + O2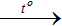
+) S+4 → S0: 2H2S + SO2 → 3S + 2H2O
+) S+4 → S+6: SO2+ Br2 + 2H2O → 2HBr + H2SO4
+) S+6 → S+4: Cu + 2H2SO4 đặc 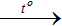
+) S0 → S+6: S + 3F2 → SF6
+) S+6 → S0: 3Zn + 4H2SO4 đặc 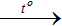
+) S-2 → S+6: H2S+ 4Cl2 + 4H2O → H2SO4 + 8HCl
+) S+6 → S2-: 4Mg + 5H2SO4 đặc 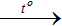
Nhận xét: với dạng bài này cần lựa chọn các chât tương ứng cho phù hợp với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
B. Bài tập trắc nghiệm
Câu 1. Viết phương trình phản ứng theo chuỗi biến hóa sau:
FeS → H2S → S → SO2 → CaSO3 → CaSO4
Lời giải:
Đáp án:
FeS + 2HCl → FeCl2 + H2S
2H2S + O2thiếu ---V2O5→ 2S + 2H2O
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + SO2 + H2O
Câu 2. Xác định các chất và hoàn thành các phương trình phản ứng sau:
FeS + A → B (khí) + C
B + CuSO4 → D↓ đen + E
B + F → G↓ vàng + H
C + J khí → L
L + KI → C + M + N
Lời giải:
Đáp án:
FeS + 2HCl → FeCl2 + H2S↑
(A) (C) (B)
H2S + CuSO4 → CuS↓ + H2SO4
(D) (E)
2H2S + SO2 → 2S↓ + 2H2O
(F) (G) (H)
2FeCl2 + Cl2 → 2FeCl3
(J) (L)
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
(M) (N)
Câu 3. Hoàn thành sơ đồ biến hóa sau:
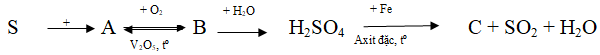
Lời giải:
Đáp án:
S + O2 → SO2 (A)
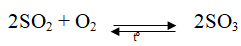
SO3 + H2O → H2SO4
6H2SO4(đ) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Câu 4. Viết phương trình phản ứng theo chuỗi biến hóa sau:
KMnO4 → Cl2 → NaClO3 → O2 → SO2 → SO3 → H2SO4
Lời giải:
Đáp án:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
2NaClO3 → 2NaCl + 3O2
O2 + S → SO2
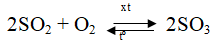
SO3 + H2O → H2SO4
Câu 5. Cặp phản ứng nào sau đây cho thấy lưu huỳnh vừa có tính khử vừa có tính oxi hóa?
A. S + H2 → H2S; S + Cu → CuS
B. S + 2H2SO4 → 3SO2 + 2H2O; S + 2Na → Na2S
C. S + 6HNO3 → H2SO4 + 6NO2 + 3H2O; S + O2 → SO2
D. S+ 3F2 → SF6 ; S + O2 → SO2
Lời giải:
Đáp án: B
Câu 6. Lưu huỳnh tác dụng với sodium hydroxide đặc, nóng:
S + NaOH → Na2S + Na2SO3 + H2O
Trong phản ứng trên, tỷ lệ số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1 : 2 B. 1 : 1 C. 1 : 2 D. 2 : 1
Lời giải:
Đáp án: D
Câu 6.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
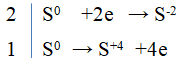
Câu 7. Cho phương trình phản ứng hóa học:
H2SO4 đặc + 8HI → 4I2 + H2S + 4H2O
A. H2SO4 là chất oxi hóa, HI là chất khử
B. HI là chất oxi hóa
C. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI
D. I2 khử H2S thành H2SO4 và nó bị khử thành HI.
Lời giải:
Đáp án: A
Câu 8. Cho các phương trình phản ứng hóa học sau:
1. SO2 + 2H2S → 3S + 2H2O
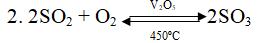
3. SO2 + Br2 + 2H2O → 2HBr + H2SO4
4. 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
5. SO2 + H2O → H2SO3
SO2 là chất oxi hóa trong các phản ứng:
A. 1, 3, 5 B. 1, 3, 4 C. 1 D. 1, 3
Lời giải:
Đáp án: C
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế Oxi, Lưu huỳnh
Tổng hợp: Bài tập về SO2, H2S, SO3 hoặc H2SO4 phản ứng với dung dịch kiềm
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

