Lý thuyết Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử (hay, chi tiết)
Bài viết Lý thuyết Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử.
Lý thuyết Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử (hay, chi tiết)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
I. Năng lượng của electron trong nguyên tử
1. Mức năng lượng obitan nguyên tử
- Trong nguyên tử, các electron trên mỗi obitan có một mức năng lượng xác định. Mức năng lượng này là mức năng lượng obitan nguyên tử (mức năng lượng AO).
- Các electron trên các obitan khác nhau của cùng một phân lớp có năng lượng như nhau.
2. Trật tự các mức năng lượng obitan nguyên tử
- Trật tự các mức năng lượng tăng dần theo trình tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
- Từ trình tự mức năng lượng AO trên cho thấy khi điện tích hạt nhân tăng có sự chèn mức năng lượng, mức 4s trở nên thấp hơn 3d, mức 5s thấp hơn 4d, 6s thấp hơn 4f, 5d, ...
II. Các nguyên lí và quy tắc phân bố electron trong nguyên tử
1. Nguyên lí Pau-li
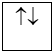
Nguyên lý Pauli: Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
1 obitan có 2e: 2e ghép đôi
1 obitan có 1e: 1e độc thân
2. Nguyên lí bền vững
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
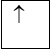
3. Quy tắc Hun
Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
Ví dụ:
III. Cấu hình electron nguyên tử
1. Cấu hình electron nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp của các lớp electron khác nhau.
a/ Cách viết cấu hình electron nguyên tử
- Xác định số electron trong nguyên tử.
- Phân bố các electron theo trật tự mức năng lượng AO tăng dần.
- Viết cấu hình electron theo thứ tự các phân lớp electron trong một lớp.
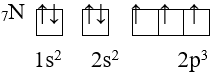
Ví dụ: 26Fe. Viết theo trật tự mức năng lượng AO tăng dần:
1s22s22p63s23p64s23d6
- Sau đó viết lại theo thứ tự các phân lớp electron trong 1 lớp:
1s22s22p63s23p63d64s2
- Viết gọn: [Ar]3d64s2
* Chú ý: Khi viết cấu hình electron để dễ nhớ trật tự các mức năng lượng, ta viết theo thứ tự lớp với 2 phân lớp s, p như sau:
1s 2s2p 3s3p 4s ... 4p 5s ... 5p 6s ... 6p 7s ... 7p
- Sau đó thêm 3d vào giữa lớp 4s ... 4p
- Thêm 4d vào giữa lớp 5s ... 5p
- Thêm 4f 5d vào giữa lớp 6s ... 6p
- Thêm 5f 6d vào giữa lớp 7s ... 7p
- Ta sẽ được: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
2. Đặc điểm của lớp electron ngoài cùng
- Các electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố.
- Số electron lớp ngoài cùng tối đa là 8e.
+ Các nguyên tử kim loại có: 1e, 2e, 3e lớp ngoài cùng.
+ Các nguyên tử phi kim có: 5e, 6e, 7e lớp ngoài cùng.
+ Các nguyên tử khí hiếm có: 8e (He có 2e) lớp ngoài cùng.
+ Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- Lý thuyết Đồng vị. Nguyên tử khối và nguyên tử khối trung bình
- Lý thuyết Sự chuyển động của electron trong nguyên tử. Obitan nguyên tử
- Lý thuyết Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử
- Lý thuyết Lớp và phân lớp electron
- Tóm tắt Lý thuyết Hóa 10 chương 1
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

