Cách xác định nguyên tố dựa vào số hạt (hay, chi tiết)
Bài viết Cách xác định nguyên tố dựa vào số hạt với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách xác định nguyên tố dựa vào số hạt.
Cách xác định nguyên tố dựa vào số hạt (hay, chi tiết)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
A. Phương pháp & Ví dụ
Nguyên tử của mỗi nguyên tố có một số Z đặc trưng nên để xác định nguyên tố ta cần xác định Z thông qua việc lập và giải phương trình về số hạt.
a) Dạng toán cơ bản cho 1 nguyên tử
Phương pháp:
- Căn cứ vào Z sẽ xác định được nguyên tử đó là thuộc nguyên tố hóa học nào
- Lưu ý: Z = số proton (p) = số electron (e) = E
Số khối: A = Z + N
Tổng số hạt = 2.Z + N
Tổng số hạt mang điện = Z + E = 2Z
Ví dụ 1: Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Vậy X là
Lời giải:
Ta có: 2.Z + N =82
2.Z - N=22
➢ Z = (82+22)/4 =26
➢ X là Fe
Công thức áp dụng nhanh: Z = (S + A )/4
Trong đó:
Z: số hiệu nguyên tử
S: tổng số hạt
A: Hiệu số hạt mang điện và không mang điện
b) Dạng toán áp dụng cho hỗn hợp các nguyên tử
Phương pháp:
Nếu là MxYy thì có thể coi có x nguyên tử M và y nguyên tử Y.
Do đó x.ZX + y.ZY = (Sphân tử + Aphân tử) / 4
Ví dụ 2: Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Vậy X là
Lời giải:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nên ta có : 2.ZM + 8 = (140 + 44) : 4 = 46 ⇒ Z =19
⇒ M là K ⇒ X là K2O
Áp dụng mở rộng công thức trên trong giải ion
➢ Nếu ion là Xx+thì ZX = (S + A+ 2x) / 4
➢ Nếu ion Yy-thì ZY = (S + A – 2y) / 4
Vậy khác biệt của công thức này với công thức ban đầu đó là thêm giá trị của điện ion
Cách nhớ: nếu ion dương thì đem + 2 lần giá trị điện ion dương, nếu âm thì – 2 lần giá trị điện ion âm)
Ví dụ 3: Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
Lời giải:
ZM = (79 + 19 +2.3) : 4 = 26 ⇒ M là sắt (Fe).
c) Dạng toán cho tổng số hạt cơ bản
Phương pháp:
Với dạng này thì ta phải kết hợp thêm bất đẳng thức:
1 ≤ N/Z ≤ 1,52 (với 82 nguyên tố đầu bảng tuần hoàn)
1 ≤ (S −2Z)/Z ≤ 1,52 ⇒ S/3,52 ≤ Z ≤ S/3
Thường với 1 số nguyên tố đầu độ chênh lệch giữa p, n, không nhiều thường là 1 hoặc 2, nên sau khi chia S cho 3 ta thường chon luôn giá trị nguyên gần nhất.
Ngoài ra có thể kết hợp công thức:
S = 2Z + N = Z + (Z + N) hay là S =Z + A
Ví dụ 4: Tổng số hạt cơ bản của nguyên tử X là 52, X thuộc nhóm VIIA. X là
Lời giải:
Z ≤ 52: 3 = 17,33 ⇒ Z là Clo (Cl)
ZM ≤ 60:3 = 20 ⇒ Ca, ZX ≤ 24 : 3 = 8 ⇒ O Vậy MX là CaO.
B. Bài tập trắc nghiệm
Câu 1. Cho nguyên tử X có tổng số hạt là 34, trong đó số hạt mang điện gấp 1,8333 lần số hạt không mang điện. Xác định số khối X?
A. 23 B. 24 C. 27 D. 11
Lời giải:
Đáp án: A
Ta có tổng số hạt trong nguyên tử: P + N + E = 34
Mà P = E = Z ⇒ 2Z + N = 34
Mặt khác số hạt mang điện gấp 1,8333 lần số hạt không mang điện nên:
2Z = 1,8333N ⇒ 1,8333N + N = 34 ⇒ N = 12 ⇒ Z = 11
Vậy X có Z = 11 nên điện tích hạt nhân là 11+
Số khối của X: A = Z + N = 23
Câu 2. Một nguyên tử nguyên tố A có tổng số proton, neutron, electron là 52. Tìm nguyên tố A.
A. Mg B. Cl C. Al D. K
Lời giải:
Đáp án: B
Ta có: 2Z + N = 52
Do bài toán có hai ẩn nhưng chỉ có một dữ kiện để lập phương trình nên ta sử dụng thêm giới hạn
1 ≤ N/Z ≤ 1,222 hay 52/3,222 ≤ Z ≤ 52/3 ⇒ 16,1 ≤ Z ≤ 17,3.
Chọn Z = 17 ⇒ N = 18 ⇒ A = 35 (nguyên tố Clo)
Câu 3. Nguyên tử của nguyên tố X có tổng số hạt là 40 .Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là :
A. 27 B. 26 C. 28 D. 23
Lời giải:
Đáp án: A
p + n + e = 40 vì p = e ⇒ 2p + n = 40 (1)
Hạt mang điện: p + e = 2p
Hạt không mang điện: n.
Theo bài: 2p – n = 12 (2)
Từ 1 và 2 ⇒ p = e = 13; n = 14 ⇒ A = p + n = 27
Vậy, kim loại X là Ca, Y là Fe.
Câu 4. Tổng số hạt proton, neutron, electron trong hai nguyên tử kim loại X và Y là 142, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 12. Hai kim loại X, Y lần lượt là
A. Na, K. B. K, Ca. C. Mg, Fe. D. Ca, Fe.
Lời giải:
Đáp án: D
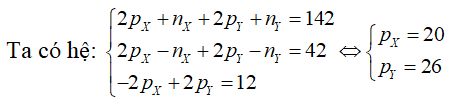
Câu 5. Tổng số hạt proton, neutron và electron trong nguyên tử nguyên tố X là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. X là nguyên tố nào sau đây ?
A. Al B. Fe C. Cu D. Ag
Lời giải:
Đáp án: D
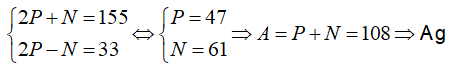
Câu 6. Một ion X3+ có tổng số hạt proton, neutron, electron là 79, trong đó số hat mang điện nhiều hơn số hạt không mang điện là 19. Viết kí hiệu của nguyên tử X.
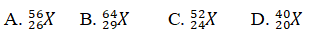
Lời giải:
Đáp án: A
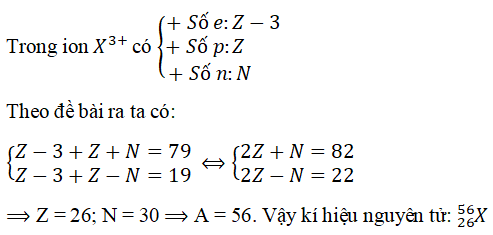
⇒ Z = 26; N = 30 ⇒ A = 56. Vậy ki hiệu nguyên tử: 2656)X
Câu 7. Tổng số các hạt trong nguyên tử M là 18. Nguyên tử M có tổng số hạt mang điện gấp đôi số hạt không mang điện. Hãy viết kí hiệu nguyên tử M.
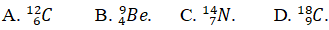
Lời giải:
Đáp án: A
Tổng số hạt trong nguyên tử : P + N + E = 18
Mà P = E = Z ⇒ 2Z + N = 18
Măt khác tổng số hạt mang điện gấp đôi số hạt không mang điện
2Z = 2N ⇒ Z = N = 6 ⇒ A = 12
Kí hiệu nguyên tử M: 612C.
Câu 8. Mỗi phân tử XY2 có tổng các hạt proton, neutron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X,Y lần lượt là
A. Fe và S B. S và O C. C và O D. Pb và Cl
Lời giải:
Đáp án: A
Kí hiệu số đơn vị điện tích hạt nhân của X là ZX , Y là ZY ; số neutron (hạt không mang điện) của X là NX, Y là NY . Với XY2 , ta có các phương trình:
tổng số hạt của X và Y là: 2 ZX + 4 ZY + NX + 2 NY = 178 (1)
Số hạt mang điện nhiều hơn không mang điện là: 2.ZX + 4.ZY - NX – 2.NY = 54 (2)
Số hạt mang điện của X ít hơn số hạt mang điện của Y là: 4.ZY – 2.ZX = 12 (3)
ZY = 16 ; ZX = 26
Vậy X là sắt, Y là lưu huỳnh ⇒ XY2 là FeS2
C. Bài tập tự luyện
Câu 1: Nguyên tử của một nguyên tố có tổng số hạt proton, neutron, electron là 122. Số hạt mang điện trong hạt nhân ít hơn số hạt không mang điện là 11 hạt. Số khối của nguyên tử trên là
A. 122.
B. 96.
C. 85.
D. 74.
Câu 2: Có hợp chất X2Y3. Tổng số hạt của hợp chất là 296 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 88. Số khối của X lớn hơn số khối của Y là 20. Số proton của Y, số electron của X, số khối của Y theo thứ tự lập thành cấp số cộng. Công thức của X2Y3 là
A. Cr2S3.
B. Al2O3.
C. Fe2O3.
D. Cr2O3.
Câu 3: Trong anion X3− có tổng số hạt là 111, số electron bằng 48% số khối. Nhận xét nào dưới đây về X là đúng?
A. Số khối của X là 75.
B. Số electron của X là 36.
C. Số hạt mang điện của X là 72.
D. Số hạt mang điện của X là 42.
Câu 4: X, Y là hai phi kim. Trong nguyên tử X và Y có số hạt mang điện nhiều hơn hạt không mang điện lần lượt là 14 và 16. Hợp chất XYn có đặc điểm: X chiếm 15,0486% về khối lượng. Tổng số proton là 100, tổng số neutron là 106. Hãy xác định công thức hợp chất XYn?
A. CO2
B. PCl5
C. Mg3N2
D. P2O5
Câu 5: Ba nguyên tử X, Y, Z có tổng số đơn vị điện tích hạt nhân bằng 16, hiệu điện tích hạt nhân X và Y là 1+. Tổng số electron trong ion X3Y− là 32. X, Y, Z lần lượt là
A. O, S, H.
B. O, N, H.
C. O, Se, H.
D. O, P, H.
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
Dạng 5: Tính phần trăm đồng vị, tính nguyên tử khối trung bình
Dạng 7: Tính kích thước, khối lượng, khối lượng riêng, bán kính nguyên tử
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

