Bài toán về năng lượng hóa học, đốt cháy nhiên liệu (cách giải + bài tập)
Chuyên đề phương pháp giải bài tập Bài toán về năng lượng hóa học, đốt cháy nhiên liệu lớp 11 chương trình sách mới hay, chi tiết với bài tập tự luyện đa dạng giúp học sinh ôn tập, biết cách làm bài tập Bài toán về năng lượng hóa học, đốt cháy nhiên liệu.
Bài toán về năng lượng hóa học, đốt cháy nhiên liệu (cách giải + bài tập)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
A. Lý thuyết và phương pháp giải
- Tính biến thiên enthalpy của phản ứng:
+ Theo nhiệt tạo thành (enthalpy tạo thành):
Enthalpy tạo thành chuẩn của đơn chất bền vững bằng 0.
+ Theo năng lượng liên kết:
- Lưu ý:
+ Nhiệt lượng (Q) tỏa ra khi đốt cháy một chất:
Qtỏa = (số mol) × (lượng nhiệt tỏa ra khi đốt cháy 1 mol chất).
+ Nhiên liệu thường là hỗn hợp các chất nên lượng nhiệt tỏa ra khi đốt cháy nhiên liệu bằng tổng lượng nhiệt đốt cháy các chất thành phần:
Qtổng = Q1 + Q2 + ….
+ Các quá trình sử dụng nhiệt thường bị thất thoát nhiệt ra môi trường nên hiệu suất sử dụng nhiệt nhỏ hơn 100%.
+ Nhiệt lượng vật tỏa ra hoặc thu vào: Q = m.C.Δt. Trong đó:
♦ m: Khối lượng chất (với dung dịch loãng coi khối lượng riêng là khối lượng riêng của nước: 1g/ml)
♦ C: Nhiệt dung riêng (năng lượng cần để đưa 1 gam chất tăng lên 1oC).
Với dung dịch loãng coi nhiệt dung của dung dịch là nhiệt dung của nước: C = 4,2 J/g.K
♦ Δt: là độ biến thiên nhiệt độ (|t2 – t1|).
B. Ví dụ minh hoạ
Ví dụ 1: Tính nhiệt tạo thành chuẩn của methane và propane. Biết nhiệt cháy chuẩn của methane và propane lần lượt bằng - 890 kJ/mol và - 2216 kJ/mol; nhiệt tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol và - 285,8 kJ/mol. Biết rằng nhiệt cháy chuẩn của một chất là biến thiên enthalpy của phản ứng đốt cháy 1 mol chất đó bằng oxygen ở điều kiện chuẩn.
Hướng dẫn giải
Nhiệt cháy của methane là biến thiên enthalpy của phản ứng:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l)
= -890 kJ
= 1.(-393,5) +2 (-285,8) + 890 = - 75,1 (kJ/mol) (= 0)
Nhiệt cháy của propane là biến thiên enthalpy của phản ứng:
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (l)
= -2216 kJ
= 3.(-393,5) + 4.( -285,8) + 2216 = - 107,7 (kJ/mol).
Ví dụ 2: Gas, nhiên liệu phổ biến hiện nay có thành phần chính là propane và butane. Nhiệt lượng giải phóng khi đốt cháy hoàn toàn 1 kg một loại gas là khoảng 50 400 kJ.
(a) Biết để làm nóng 1 kg nước lên 1 độ thì cần cung cấp nhiệt lượng là 4 200 J. Để đun sôi 30 kg nước từ nhiệt độ 20oC cần cung cấp bao nhiêu kJ nhiệt?
A. 2520 kJ.
B. 5040 kJ.
C. 10080 kJ.
D. 6048 kJ.
(b) Cần đốt cháy hoàn toàn bao nhiêu kg gas để cung cấp đủ nhiệt lượng trên, biết hiệu suất hấp thụ nhiệt đạt 80%?
A. 0,02 kg.
B. 0,25 kg.
C. 0,16 kg.
D. 0,40 kg.
Hướng dẫn giải
(a) Đáp án đúng là: C
Để đun sôi 30 kg nước từ nhiệt độ 20oC, cần cung cấp nhiệt lượng là:
kJ.
(b) Đáp án đúng là: B
Số kg gas cần đốt cháy để cung cấp đủ nhiệt lượng trên là:
kg.
C. Bài tập minh hoạ
Câu 1. Cho phản ứng đốt cháy butane sau: C4H10(g) + O2(g) → CO2(g) + H2O(g) (1)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
Liên kết |
Phân tử |
Eb (kJ/mol) |
Liên kết |
Phân tử |
Eb (kJ/mol) |
C – C |
C4H10 |
346 |
C = O |
CO2 |
799 |
C – H |
C4H10 |
418 |
O – H |
H2O |
467 |
O = O |
O2 |
495 |
Một bình gas chứa 12 kg butane có thể đun sôi số ấm nước là (Giả thiết mỗi ấm nước chứa 2 L nước ở 25oC, nhiệt dung riêng của nước là 4,2 J/g.K, có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường)
A. 718.
B. 818.
C. 918.
D. 881.
Hướng dẫn giải
Đáp án đúng là: C
Xét phản ứng:
C4H10(g) + O2(g) 4CO2(g) + 5H2O(g)
Ta có: 3.EC-C + 10.EC-H + 6,5.EO=O – 4.2.EC=O – 5.2.EO-H
= 3.346 + 10.418 + 6,5.495 – 8.799 – 10.467 = - 2626,5 (kJ).
Lại có:
Nhiệt cần đun 1 ấm nước: 2.103.4,2.(100 – 25) = 630 000 (J) = 630 (kJ).
Số ấm nước: (ấm nước).
Câu 2. Một mẫu khí gas X chứa hỗn hợp propane và butane. Cho các phản ứng:
Đốt cháy hoàn toàn 12 gam mẫu khí gas X tỏa ra nhiệt lượng 597,6 kJ. Tỉ lệ số mol của propane và butane trong X là
A. 1 : 2.
B. 2 : 1.
C. 1 : 3.
D. 3 : 1.
Hướng dẫn giải
Đáp án đúng là: A
12 gam X tỏa ra lượng nhiệt là: (2)
Từ (1) và (2) ta có hệ phương trình:
Câu 3. Khi đốt cháy 1 mol propane toả ra lượng nhiệt là 2 220 kJ. Để đun nóng 1 gam nước tăng thêm 1 °C cần cung cấp nhiệt lượng là 4,2 J. Khối lượng propane cần dùng để đun 1L nước từ 25 °C lên 100 °C là (Cho biết 75% nhiệt lượng toả ra khi đốt cháy propane dùng để nâng nhiệt độ của nước. Khối lượng riêng của nước là 1 g/mL)
A. 6,24 gam.
B. 6,24 kg.
C. 8,32 gam.
D. 8,32 kg.
Hướng dẫn giải
Đáp án đúng là: C
Nhiệt lượng cần cung cấp trên lí thuyết để đun nóng 1 L nước hay 1 000 gam nước từ 25 °C lên 100 °C là: Q = 1 000 × (100 - 25) × 4,2 = 315 000 (J) = 315 (kJ).
Khối lượng propane trên lí thuyết cần là: .
Khối lượng propane thực tế cần lấy: .
Câu 4. Khí đốt hóa lỏng (Liquified Petroleum Gas, viết tắt là LPG) hay còn được gọi là gas, là hỗn hợp khí chủ yếu gồm propane (C3H8) và butane (C4H10) đã được hóa lỏng. Một loại gas dân dụng chứa khí hóa lỏng có tỉ lệ mol propane : butane là 40 : 60. Đốt cháy 1 lít khí gas này ở (25oC, 1 bar) thì tỏa ra nhiệt lượng gần nhất với (Biết khi đốt cháy 1 mol mỗi chất propane và butane tỏa ra lượng nhiệt tương ứng 2220 kJ và 2875 kJ)
A. 105, 317 J.
B. 105, 317 kJ.
C. 105, 317 cal.
D. 105, 317 kcal.
Hướng dẫn giải
Đáp án đúng là: B
Trong 1 lít gas ta có 0,4 lít propane (tương đương 0,0161 mol) và 0,6 lít butane (tương đương 0,0242 mol). Vậy lượng nhiệt tỏa ra là:
0,0161 . 2220 + 0,0242 . 2875 = 105,317 kJ.
Câu 5. Một mẫu khí gas X chứa hỗn hợp propane và butane. Đốt cháy hoàn toàn 12 gam mẫu khí gas X tỏa ra nhiệt lượng 594 kJ. Biết rằng, khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Tỉ lệ số mol của propane và butane trong X là
A. 1 : 2.
B. 2 : 3.
C. 1 : 1.
D. 3 : 2.
Hướng dẫn giải
Đáp án đúng là: A
Câu 6. Một bình gas (khí hóa lỏng) chứa hỗn hợp propane và butane với tỉ lệ mol 1 : 2. Cho biết các phản ứng:
C3H8 (g) + 5O2 (g) 3CO2 (g) + 4H2O (l)
C4H10 (g) + O2 (g) 4CO2 (g) + 5H2O (l)
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10000 kJ nhiệt (hiệu suất hấp thụ nhiệt là 80%). Số ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg là
A. 18 ngày.
B. 28 ngày.
C. 38 ngày.
D. 48 ngày.
Hướng dẫn giải
Đáp án đúng là: D
Gọi số mol C3H8 và số mol C4H10 là 2a, ta có:
44a + 58.2a = 12.1000 Þ a = 75 mol.
Nhiệt đốt cháy 12 kg gas là Q = 75.2220 + 150.2874 = 597 600 (kJ).
Số ngày sử dụng hết bình gas = (ngày).
Câu 7. Bình gas loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí gas của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình gas trên?
A. 30 ngày.
B. 60 ngày.
C. 40 ngày.
D. 20 ngày.
Hướng dẫn giải
Đáp án đúng là: C
Lượng nhiệt tỏa ra khi đốt cháy hết 12 kg khí gas trên là:
91,6.2220 + 137,4.2850 = 594942 kJ.
Vì H = 67,3% nhiệt sử dụng thực tế là 594942.67,3% = 400396 kJ.
Số ngày gia đình Y sử dụng hết bình gas là ngày.
Câu 8. Một loại bình gas có chứa 13 kg khí thiên nhiên có thành phần chính là khí methane, ethane và một số thành phần khác, trong đó tỉ lệ thể tích của methane : ethane là 85 : 15 (thành phần khác không đáng kể). Khi đốt cháy hoàn toàn, 1 mol methane cháy tỏa ra lượng nhiệt là 802 kJ và 1 mol ethane cháy tỏa lượng nhiệt là 1428 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí gas trên của một hộ gia đình X là 10000 kJ/ngày, hiệu suất sử dụng nhiệt là 62%, giá của bình gas trên là 450 000 đồng. Số tiền một hộ gia đình X cần trả cho việc mua gas trong một tháng (30 ngày) gần nhất với giá trị nào sau đây?
A. 345 000 đồng.
B. 297 000 đồng.
C. 414 000 đồng.
D. 333 000 đồng.
Hướng dẫn giải
Đáp án đúng là: D
13 kg gas tỏa ra lượng nhiệt là:
Vậy hộ gia đình trên sẽ sử dụng hết bình gas 13 kg trong: ngày.
Số tiền hộ gia đình X cần trả trong 1 tháng là đồng.
Câu 9. Một bình gas sử dụng trong hộ gia đình X có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí gas của hộ gia đình X là 10000 kJ/ngày và sau 45 ngày gia đình X dùng hết bình gas trên. Hiệu suất sử dụng nhiệt của hộ gia đình X gần nhất với giá trị nào sau đây?
A. 62,5%.
B. 75,6%.
C. 70,8%.
D. 67,3%.
Hướng dẫn giải
Đáp án đúng là: B
- Lượng nhiệt tỏa ra khi đốt cháy hết 12 kg khí gas trên là:
91,6.2220 + 137,4.2850 = 594942 kJ.
- Lượng nhiệt hộ gia đình X đã tiêu thụ là 45.10000 = 450000 kJ.
Hiệu suất sử dụng nhiệt của hộ gia đình X là .
Câu 10. Một bình gas (khí hóa lỏng) có chứa 12 kg hỗn hợp propane và butane, trong đó propane chiếm 27,5% về khối lượng. Khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí gas của một hộ gia đình X là 10000 kJ/ngày, hiệu suất sử dụng nhiệt là 70%, giá của bình gas trên là 400000 đồng. Số tiền hộ gia đình X cần trả cho việc mua gas trong một tháng (30 ngày) gần nhất với giá trị nào sau đây?
A. 250 000 đồng.
B. 290 000 đồng.
C. 310 000 đồng.
D. 350 000 đồng.
Hướng dẫn giải
Đáp án đúng là: B
Tổng lượng nhiệt tỏa ra khi đốt cháy 12 kg khí gas là 75.2220 + 150.2850 = 594000 kJ.
Vì H% = 70% lượng nhiệt thực tế đã dùng là 594000.70% = 415800 kJ.
Số ngày dùng hết bình gas là ngày.
41,58 ngày dùng hết bình gas trị giá 400000 đồng.
1 tháng (30 ngày) tiêu tốn hết đồng.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học 11 hay, chi tiết khác:
- Ứng dụng độ bất bão hoà, xác định công thức cấu tạo của hợp chất hữu cơ
- Bài tập về phản ứng thế halogen
- Bài tập về phản ứng cộng
- Bài tập về phản ứng trùng hợp
- Bài tập về phản ứng của alk-1-yne với dung dịch AgNO3 trong NH3
- Bài tập về phản ứng của alcohol với kim loại kiềm
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

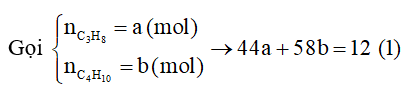
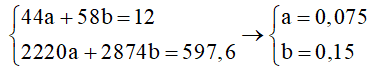
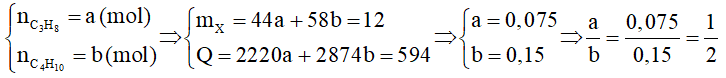
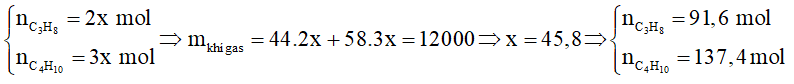
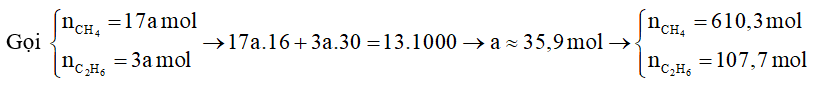
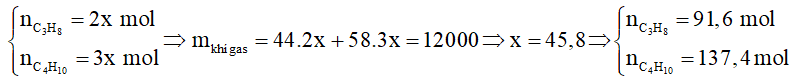
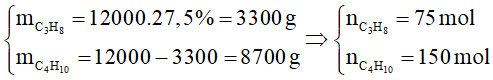



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

