Lý thuyết Mở đầu về hóa học hữu cơ (hay, chi tiết nhất)
Bài viết Lý thuyết Mở đầu về hóa học hữu cơ hay, chi tiết giúp bạn nắm vứng kiến thức trọng tâm về Mở đầu về hóa học hữu cơ.
Lý thuyết Mở đầu về hóa học hữu cơ (hay, chi tiết nhất)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Bài 20 : Mở đầu về hóa học hữu cơ - Cô Nguyễn Nhàn (Giáo viên VietJack)
I. Hợp chất hữu cơ và hóa học hữu cơ
1. Khái niệm
- Hợp chất hữu cơ là các hợp chất của C trừ oxit của C, muối cacbua, muối carbonate, muối xianua.
- Hoá học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
2. Phân loại hợp chất hữu cơ.
Hợp chất hữu cơ được chia thành hidrcacbon và dẫn xuất hidrcacbon.
a/ Hidrcacbon là loại hợp chất hữu cơ đơn giản nhất, trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
- hydrocarbon mạch hở:
+ hydrocarbon no: alkane CH4
+ hydrocarbon không no có một nối đôi: alkene C2H4
+ Hidrcacbon không no có hai nối đôi: alkadiene
- hydrocarbon mạch vòng:
+ hydrocarbon no: cycloalkane
+ hydrocarbon mạch vòng: Aren
b/ Dẫn xuất của hydrocarbon là những hợp chất mà trong phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen...
- Dẫn xuất halogen: R – X ( R là gốc hydrocarbon?
- Hợp chất chứa nhóm chức:
- OH - : ancol; - O - : ete; - COOH: axit......
3/ Đặc điểm chung
- Hợp chất hữu cơ nhất thiết phải chứa C, hay có H thường gặp O ngoài ra còn có halogen, N, P...
- Liên kết chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Các hợp chất hữu cơ thường dễ bay hơi, dễ cháy, kém bền nhiệt.
- Các phản ứng trong hoá học hữu cơ thường chậm, không hoàn toàn, xảy ra theo nhiều hướng thường phải đun nóng và có xúc tác.
4/ Các phương pháp tinh chế hợp chất hữu cơ
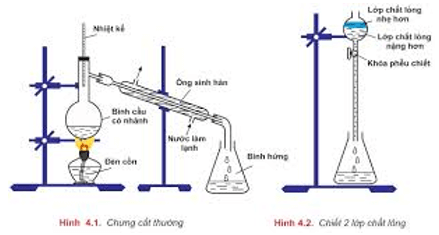
- Chưng cất: để tách các chất lỏng có nhiệt độ sôi khác nhau nhiều.
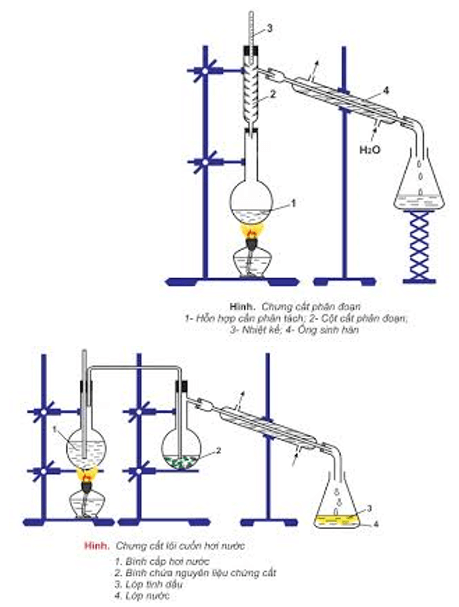
- Chiết: để tách hai chất lỏng không trộn lẫn vào nhau.
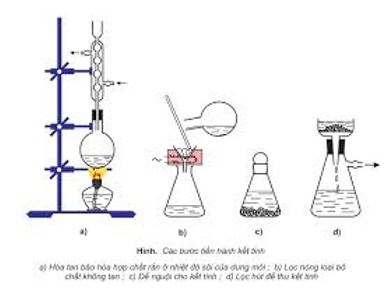
- Kết tinh lại: để tách các chất rắn có độ tan khác nhau theo nhiệt độ.
II. Phân tích nguyên tố
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định :
- Thành phần định tính nguyên tố.
- Thành phần định lượng nguyên tố.
- Xác định khối lượng phân tử.
1. Phân tích định tính nguyên tố.
- Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa trong một chất.
- Muốn xác định thành phần các nguyên tố , người ta chuyển các nguyên tồ trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận ra các sản phẩm đó.
a. Xác định cacbon và hidro.
- Nhận Cacbon: Đốt cháy hợp chất hữu cơ:
C −+O2→ CO2 −+Ca(OH)2→ CaCO3
- Nhận Hidro: Đốt cháy hợp chất hữu cơ:
2H −+O2→ H2O −+CuSO4 khan→ CuSO4.5H2O ( màu xanh lam)
- Hoặc có thể dùng chất hút nước mạnh như : H2SO4 đđ, CaCl2 khan, P2O5.
b. Xác định nitơ và oxi.
- Nhận N: Đốt cháy hợp chất hữu cơ, nếu có mùi khét thì hợp chất đó có nitơ.
Hoặc đun hợp chất hữu cơ với H2SO4 đặc ( NaOH đặc) có mùi khai NH3 thì hợp chất đó có chứa nitơ.
CxHyOzNt −+ H2SO4đ, tº→ (NH4)2SO4+......
(NH4)2SO4 + 2NaOH −tº→ Na2SO4 + H2O + NH3↑
- Nhận O : Khó phân tích định tính trực tiếp, thường xác định nhờ định lượng:
mO = mhợp chất – tổng khối lượng các nguyên tố
c. Xác định halogen.
Khi đốt cháy hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl, ta dùng dung dịch AgNO3
HCl + AgNO3 → AgCl↓ + HNO3
2. Phân tích định lượng các nguyên tố:
- Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
- Muốn định lượng nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản, định lượng chúng, từ đó suy ra khối lượng từng nguyên tố có trong một chất.
a. Định lượng cacbon và hidro.
VD: Đốt cháy chất hữu cơ A thu được CO2 và H2O và N2
mC (A) = mC(CO2) = nCO2.12
mH(A) = mH(H2O) = nH2O.2
b. Định lượng nitơ
mN(A) = nN2.28
c. Định lượng oxi
mO = m(A) – ( mC + mH + mN ).
* Chú ý :
- Dùng H2SO4 đặc, P2O5, CaCl2 khan hấp thụ H2O.
- Dùng NaOH, KOH, Ca(OH)2 hấp thụ CO2, độ tăng khối lượng của bình hay khối lượng kết tủa CaCO3 giúp ta tính được CO2
- Chỉ dùng CaO, Ca(OH)2, NaOH hấp thụ sản phẩm gồm CO2 và H2O thì khối lượng bình tăng chính là tổng khối lượng CO2 và H2O.
3. Thành phần nguyên tố:
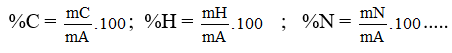
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Công thức phân tử hợp chất hữu cơ
- Lý thuyết Cấu trúc phân tử hợp chất hữu cơ
- Lý thuyết Phản ứng hữu cơ
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

