Cách giải bài tập Phản ứng oxi hóa alkane (hay, chi tiết)
Bài viết Cách giải bài tập Phản ứng oxi hóa alkane với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Phản ứng oxi hóa alkane.
Cách giải bài tập Phản ứng oxi hóa alkane (hay, chi tiết)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Phương pháp giải bài toán cracking alkane - Cô Nguyễn Thị Nhàn (Giáo viên VietJack)
A. Phương pháp giải & Ví dụ minh họa
Phản ứng đốt cháy alkane:
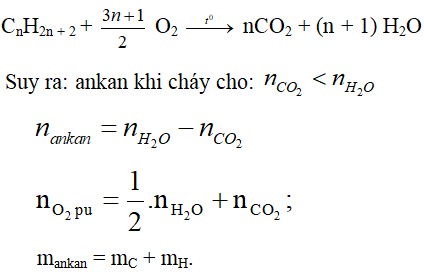
* Nếu có hỗn hợp gồm gồm hai alkane:
CnH2n + 2 : x mol
CmH2m + 2 : y mol
Gọi công thức trung bình của hai alkane là:

Ví dụ minh họa
Bài 1: Đốt cháy hoàn toàn 2,24 lít hỗn hợp X (đktc) gồm CH4, C2H6 và C3H8 thu được 4,48 lit khí CO2 (đktc) và m gam H2O. Giá trị của V là
Lời giải:
nX = 2,24/22,4 = 0,1 mol; nCO2 = 4,48/22,4 = 0,2 mol
nX = nH2O - nCO2 ⇒ nH2O = nCO2 + nX = 0,2 + 0,1 = 0,3 mol
⇒ m = 0,3.18 = 5,4 (gam)
Bài 2: Đốt cháy hoàn toàn 6 gam hỗn hợp X gồm hai alkane cần hết 15,68 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư, thu được m gam kết tủa. Giá trị của m là
Lời giải:

Bài 3: Đốt cháy hoàn toàn 1 hydrocarbon A ( là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình 1 tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. Xác định CTPT của A.
Lời giải:
Khối lượng bình 1 tăng là khối lượng của H2O ⇒ nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 ⇒ nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O ⇒ hydrocarbon là alkane;
Số mol alkane là nalkane = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
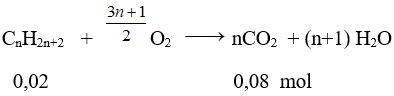
⇒ n = 0,08/0,02 = 4
CTPT của A là C4H10
Bài 4: Đốt cháy hoàn toàn 6,8g hỗn hợp khí X gồm: alkane A và CH4, sản phẩm cháy dẫn vào bình 1 đựng P2O5 và bình 2 đựng 1000 ml Ba(OH)2 0,5M. Sau thí nghiệm khối lượng bình 1 tăng 12,6g.
a. Tìm công thức phân tử của A, biết VA : VCH4 = 2 : 3.
b. Tính khối lượng các chất trong X.
c. Tính khối lượng muối tạo thành.
Lời giải:
VA : VCH4 = 2 : 3 ⇒ nA : nCH4 = 2x : 3x
Khối lượng bình 1 tăng là khối lượng của H2O: nH2O = 12,6/18 = 0,7 mol
a. Gọi CTPT của alkane là CnH2n+2
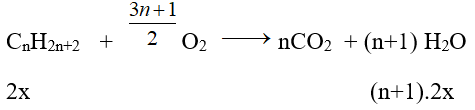
CH4 + 2O2 → CO2 + 2H2O
3x 6x
Ta có: (14n + 2).2x + 16.3x = 6,8 (1) ; (n + 1).2x + 6x = 0,7(2)
Từ 1, 2 ⇒ x = 0,05 và nx = 0,15 ⇒ n = 3
Vậy CTPT của A là C3H8
b. Khối lượng của mỗi an kan trong hỗn hợp X là
mC3H8 = 2.0,05.44 = 4,4 gam ⇒ mCH4 = 6,8 – 4,4 = 2,4 gam
c. Số mol CO2 tạo thành là nCO2 = 2.0,15 + 3.0,05 = 0,45 mol
Số mol Ba(OH)2 là: nBa(OH)2 = 1.0,5 = 0,5 mol
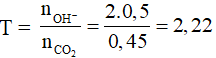
Khối lượng muối tạo thành: mBaCO3 = 0,45.197 = 88,65 gam
Bài 5: Đốt cháy hoàn toàn một lượng hi đrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 (dư) tạo ra 29,55 gam kết tủa, dung dịch sau phản ứng có khối lượng giảm 19,35 gam so với dung dịch Ba(OH)2 ban đầu. Công thức phân tử X là
Lời giải:
nC = nCO2 = nBaCO3 = 29,55/197 = 0,15 mol
mgiảm = mBaCO3 - (mCO2 + mH2O) = 19,35 mol ⇒ mCO2 + mH2O = 10,2g
mH2O = 10,2 – 0,15.44 = 3,6 (gam) ⇒ nH2O = 3,6/18 = 0,2 mol ⇒ nH = 0,4 mol
nC : nH = 0,15 : 0,4 = 3 : 8 ⇒ CTPT: C3H8
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hydrocarbon X, rồi hấp thụ hoàn toàn sản phẩm cháy vào dd Ba(OH)2 dư, thấy có 49,25 gam kết tủa xuất hiện và khối lượng dd sau phản ứng giảm đi 32,85 gam. CTPT của X là:
A. C5H12 B. C2H6 C. C3H8 D. C4H10
Lời giải:
Đáp án: A
nCO2 = nBaCO3 = 49,25/197 = 0,25 mol ; mCO2 + mH2O = 49,25 – 32,85 = 16,4
mH2O = 16,4 – 0,25.44 = 5,4 ; nH2O = 5,4/18 = 0,3 mol ; nH2O > nCO2 ⇒ X là alkane ;
CTPT của X là : CnH2n+2 ; n = 0,25/0,05 = 5⇒ X : C5H12
Bài 2: Khi đốt cháy hoàn toàn 7,84 lít hỗn hợp khí gồm CH4, C2H6, C3H8 (đktc) thu được 16,8 lít khí CO2 (đktc) và x gam H2O. Giá trị của x là
A. 6,3. B. 13,5. C. 18,0. D. 19,8.
Lời giải:
Đáp án: D
nH2O = nCO2 + nhh = 16,8/22,4+ 7,84/22,4 = 1,1 mol ⇒ x = 1,1.18 = 19,8 gam
Bài 3: Đốt cháy hoàn toàn 4,48 lít hỗn hợp gồm C2H6 và C3H8 (đkc) rồi cho sản phẩm cháy đi qua bình 1 đựng H2SO4 đặc, bình 2 đựng dd nước vôi trong có dư thì thấy khối lượng bình 1 tăng m gam, bình 2 tăng 2,2 gam. Tính m.
A. 3,5 B. 4,5 C. 5,4 D. 7,2
Lời giải:
Đáp án: B
m = (4,48/22,4+ 2,2/44).18= 4,5 gam
Bài 4: Đốt cháy hết 2,24 lít alkane X (đktc), dẫn toàn bộ sản phẩm cháy vào dd nước vôi trong dư thấy có 40g kết tủa. CTPT X
A. C2H6 B. C4H10 C. C3H6 D. C3H8
Lời giải:
Đáp án: B
CTPT của X là CnH2n+2 ; n = nCO2 /nX = 4
Bài 5: Đốt cháy hoàn toàn 0,56 lit butan ( đktc) và cho sản phẩm cháy hấp thụ hoàn toàn vào 400ml dd Ba(OH)2 0,2M. Số gam kết tủa tạo thành:
A. 9,85g B. 9,98g C. 10,4g D.11,82g
Lời giải:
Đáp án: D
nC4H10 = 0,56/22,4 = 0,025 mol ⇒ nCO2 = 4.0,025 = 0,1 mol; nH2O = 5.0,025 = 0,125 mol; T = nOH-/nCO2 = 0,16/0,1 = 1,6 ⇒ tạo ra 2 muối; nCO32- = 0,06 ⇒ mCaCO3 = 0,06.197 = 11,82 gam
Bài 6: Đốt cháy hết 2,24 lít alkane X (đktc), dẫn toàn bộ sản phẩm cháy vào dd nước vôi trong dư thấy có 40g kết tủa. CTPT X
A. C2H6 B. C4H10 C. C3H6 D. C3H8
Lời giải:
Đáp án: B
CTPT của X là CnH2n+2 ; n = nCO2 /nX = 4
Bài 7: Đốt cháy hoàn toàn một hydrocarbon X thu được 0,11 mol CO2 và 0,132 mol H2O. Khi X tác dụng với khí Clo (theo tỉ lệ số mol 1 : 1) thu được một sản phẩm hữu cơ duy nhất . Tên gọi của X là
A. 2,2-dimethylpropan B. etan
C. 2-methylpropan D. 2- metylbutan
Lời giải:
Đáp án: A
nH2O > nCO2 ⇒ X là alkane
Có CTPT là CnH2n+2
nX = nH2O - nCO2 = 0,132 – 0,11 = 0,022 (mol)
⇒ 0,022n = 0,11 ⇒ n = 5 ⇒ CTPT: C5H12
C5H12 tác dụng với khí Clo thu được sản phẩm hữu cơ duy nhất nên CTCT của X là:
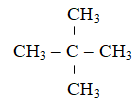
Bài 8: Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm methane, etan, propane bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (đktc) và 9,9 gam nước. thể tích không khí (dktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên niên trên là
A. 70,0 lít B. 78,4 lít C. 84,0 lít D. 56,0 lít.
Lời giải:
Đáp án: A
nCO2 = 7,84/22,4 - 0,35 mol; nH2O = 9,9/18 = 0,55 mol
Bảo toàn nguyên tố O:
2nO2 = 2nCO2 + nH2O ⇒ nO2 = 0,625 mol ⇒ VO2 = 0,625.22,4 = 14 lit
Vì oxi chiếm 1/5 Vkk ⇒ Vkk = 5.14 = 70 (lít)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Lý thuyết alkane
- Lý thuyết cycloalkane
- Dạng 1: Dạng bài tập về đồng phân, gọi tên alkane, cycloalkane
- Dạng 2: Phản ứng halogen hóa alkane
- Dạng 4: Phản ứng đề hidro hóa và cracking alkane
- Dạng 5: Các dạng bài tập về cycloalkane
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

