Bài tập Phản ứng trao đổi trong hóa học vô cơ có lời giải
Tài liệu Bài tập Phản ứng trao đổi trong hóa học vô cơ có lời giải Hóa học lớp 9 với đầy đủ phương pháp giải chi tiết, các bài tập tự luyện đa dạng ở nhiều mức độ giúp bạn biết cách giải các dạng bài tập môn Hóa học lớp 9 từ đó ôn tập và đạt điểm cao trong bài thi môn Hóa học 9.
Bài tập Phản ứng trao đổi trong hóa học vô cơ có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Khái niệm: Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
- Điều kiện xảy ra phản ứng trao đổi: Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có ít nhất một trong các chất sau: chất không tan; chất khí; H2O.
- Một số phản ứng trao đổi thường gặp:
+ Phản ứng trao đổi giữa hai dung dịch muối:
Ví dụ: NaCl + AgNO3 → AgCl↓ + NaNO3;
+ Phản ứng trao đổi giữa muối và axit:
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
+ Phản ứng trao đổi giữa dung dịch muối và dung dịch bazơ:
Ví dụ: Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
- Lưu ý: Phản ứng trung hòa cũng thuộc phản ứng trao đổi và luôn xảy ra:
Ví dụ:
NaOH + HCl → NaCl + H2O
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O.
II – MỘT SỐ VÍ DỤ MINH HỌA
Ví dụ 1. Cặp chất nào sau đây không thể tồn tại trong 1 dung dịch (do có phản ứng với nhau) ?
A. KOH, MgSO4.
B. NaCl, K2SO4.
C. CaCl2, KNO3.
D. ZnSO4, H2SO4.
Lời giải:
Đáp án A
2KOH + MgSO4 → Mg(OH)2 ↓ + K2SO4.
Ví dụ 2: Cho 200g dung dịch KOH 5,6% vào dung dịch CuCl2 dư, sau phản ứng thu được lượng chất kết tủa là
A. 19,6 gam.
B. 9,8 gam.
C. 4,9 gam.
D. 17,4 gam.
Lời giải:
Đáp án B
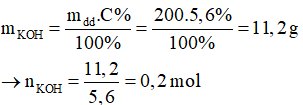
2KOH + CuCl2 → Cu(OH)2 ↓ + 2KCl
0,2 …………………0,1 mol
→ Khối lượng kết tủa: m↓ = 0,1. (64 + 17.2) = 9,8 gam.
Ví dụ 3. Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m gam chất rắn. Giá trị m là
A. 8 gam.
B. 4 gam.
C. 6 gam.
D. 12 gam.
Lời giải:
Đáp án A
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
0,1 0,3 mol
Ta có:
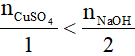
Vậy NaOH dư, số mol Cu(OH)2 tính theo số mol CuSO4
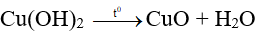
0,1…………… 0,1 mol
→ m = 0,1.80 = 8 gam.
III – BÀI TẬP VẬN DỤNG
Bài 1: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong một dung dịch?
A. FeCl3 và NaOH.
B. HCl và NaHCO3
C. NaCl và KOH.
D. NaCl và AgNO3.
Lời giải:
Đáp án C
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
HCl + NaHCO3 → NaCl + CO2↑ + H2O
NaCl + KOH → không phản ứng.
NaCl + AgNO3 → AgCl↓ + NaNO3.
Bài 2: Cho khoảng 2 ml dung dịch Na2CO3 đặc vào ống nghiệm đựng khoảng 2 ml dung dịch CaCl2. Hiện tượng xảy ra là
A. xuất hiện kết tủa vàng
B. xuất hiện kết tủa trắng.
C. xuất hiện bọt khí không mầu.
D. xuất hiện bọt khí màu nâu đỏ.
Lời giải:
Đáp án B
Na2CO3 + CaCl2 → CaCO3 (↓ trắng) + 2NaCl
Bài 3: Trung hoà 200g dung dịch HCl 3,65% bằng dung dịch KOH 1M . Thể tích dung dịch KOH cần dùng là
A. 100 ml .
B. 300 ml.
C. 400 ml.
D. 200 ml.
Lời giải:
Đáp án D
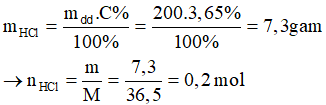
HCl + KOH → KCl + H2O
0,2 → 0,2 mol
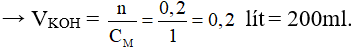
Bài 4: Trung hoà 100 ml dung dịch H2SO4 1M bằng V (ml) dung dịch NaOH 1M. Giá trị của V là
A. 50 ml .
B. 200 ml.
C. 300 ml.
D. 400 ml.
Lời giải:
Đáp án B
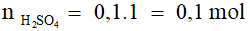
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,1 → 0,2 mol
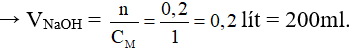
Bài 5. Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO4 1M thì dung dịch tạo thành sau phản ứng sẽ:
A. Làm quỳ tím chuyển đỏ
B. Làm quỳ tím chuyển xanh
C. Làm dung dịch phenolphtalein không màu chuyển đỏ.
D. Không làm thay đổi màu quỳ tím.
Lời giải:
Đáp án D
nNaOH = 0,2.1 = 0,2 mol;
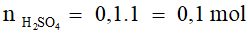
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,2………0,1 mol
Theo PTHH, sau phản ứng NaOH và H2SO4 đều hết, dung dịch thu được Na2SO4 không làm đổi màu quỳ tím.
Bài 6. Cho 12,6 gam Na2SO3 tác dụng với H2SO4 dư. Thể tích SO2 thu được (đktc) là
A. 1,12 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 3,36 lít.
Lời giải:
Đáp án B
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
0,1……………………………..0,1 mol
→ Vkhí = 0,1.22,4 = 2,24 lít.
Bài 7. Biết 6 gam muối hỗn hợp muối gồm: CaCO3 và CaSO4 tác dụng vừa đủ với 200ml dung dịch HCl thu được 0,336 lít khí (ở đktc). Thành phần % theo khối lượng của CaCO3 và CaSO4 có trong hỗn hợp ban đầu lần lượt là
A. 25% và 75%.
B. 30% và 70%.
C. 75% và 25%.
D. 70% và 30%.
Lời giải:
Đáp án A
Trong hai muối chỉ có CaCO3 tác dụng với HCl.
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
0,015…………………… 0,015 mol
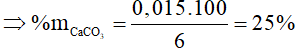
Bài 8. Cho 4,2 gam MgCO3 tác dụng với 250 ml dung dịch H2SO4 1M đến khi phản ứng xảy ra hoàn toàn. Nồng độ mol của muối trong dung dịch sau phản ứng là (coi thể tích dung dịch sau phản ứng vẫn là 250 ml).
A. 0,2M.
B. 0,25M.
C. 0,5M.
D. 0,4M.
Lời giải:
Đáp án A
MgCO3 + H2SO4 → MgSO4 + CO2 (↑) + H2O
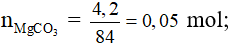
naxit = 0,25.1 = 0,25 mol.
Có
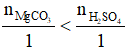
→ H2SO4 dư.
Dung dịch sau phản ứng gồm: MgSO4: 0,05 mol và H2SO4 dư
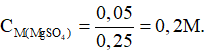
Bài 9. Cho 10,5 gam hỗn hợp X gồm Na2CO3 và K2CO3 tác dụng với HCl dư thì thu được 2,016 lit CO2 ở đktc. Phần trăm khối lượng Na2CO3 có trong X là
A. 60,57%.
B. 39,43%.
C. 57,06%.
D. 43,39%.
Lời giải:
Đáp án A
Đặt số mol của Na2CO3 và K2CO3 lần lượt là x và y mol.
Ta có: mX = 10,5 gam → 106x + 138y = 10,5 (1)
Phương trình hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
x……………………………..x mol
K2CO3 + 2HCl → 2KCl + CO2 + H2O
y………………………….y mol
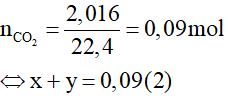
Từ (1) và (2) có x = 0,06 và y = 0,03.
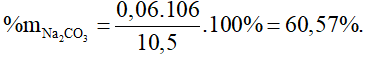
Bài 10: Cho 1,5 gam muối natri halogenua vào dd AgNO3 dư, thu được 2,35 gam kết tủa. Halogen là
A. F (M = 19).
B. Cl (M = 35,5).
C. Br (M = 80).
D. I (M = 127).
Lời giải:
Đáp án D
Đặt muối natri halogenua là NaX. Ta có:
NaX + AgNO3 → AgX ↓ + NaNO3
Theo PTHH có nNaX= nAgX nên
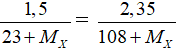
Giải phương trình được Mx = 127. Vậy X là iot
Xem thêm các dạng bài tập Hóa học lớp 9 chọn lọc, có lời giải chi tiết hay khác:
- Bài tập Muối tác dụng với bazo có lời giải
- Bài tập Kim loại tác dụng với axit có lời giải
- Bài tập Kim loại tác dụng với muối có lời giải
- Bài tập Kim loại tác dụng với nước có lời giải
- Bài tập về Nhôm và hợp chất của nhôm có lời giải
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k10 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều









