Bài tập Kim loại tác dụng với axit có lời giải
Tài liệu Bài tập Kim loại tác dụng với axit có lời giải Hóa học lớp 9 với đầy đủ phương pháp giải chi tiết, các bài tập tự luyện đa dạng ở nhiều mức độ giúp bạn biết cách giải các dạng bài tập môn Hóa học lớp 9 từ đó ôn tập và đạt điểm cao trong bài thi môn Hóa học 9.
Bài tập Kim loại tác dụng với axit có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
Dãy hoạt động hóa học của một số kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
Các kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại có thể tác dụng được với dung dịch axit (H2SO4 loãng, HCl …) tạo thành muối và giải phóng H2.
Ví dụ:
Mg + 2HCl → MgCl2 + H2 ↑
Fe + H2SO4 loãng → FeSO4 + H2 ↑
Chú ý:
- Các kim loại có nhiều hóa trị (ví dụ: Fe; Cr …) khi tác dụng với các axit HCl; H2SO4 loãng thu được muối trong đó kim loại ở mức hóa trị thấp nhất.
Ví dụ: Sắt có thể có hóa trị II hoặc III trong hợp chất, khi sắt tác dụng với HCl hay H2SO4 loãng chỉ thu được muối sắt (II).
- Nếu kim loại tan trong nước (như Na, K…) tác dụng với dung dịch axit (HCl; H2SO4 loãng …) giải phóng H2, thì cần lưu ý:
+) Nếu dung dịch axit dư chỉ có phản ứng kim loại + axit.
+) Nếu kim loại dùng dư, xét các phản ứng theo thứ tự:
1) Kim loại + axit
2) Kim loại + nước trong dung dịch.
- Kim loại tác dụng với axit sunfuric đặc tạo thành muối sunfat và không giải phóng H2.
Ví dụ:
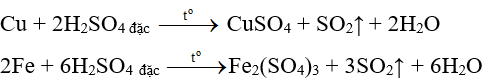
Đề giải các bài tập về kim loại tác dụng với axit thông thường là áp dụng tính toán theo phương trình hóa học, ngoài ra có thể phối hợp các phương pháp bảo toàn khối lượng, tăng giảm khối lượng, bảo toàn nguyên tố …
II – MỘT SỐ VÍ DỤ MINH HỌA
Ví dụ 1. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là
A. Fe, Cu, Mg.
B. Zn, Fe, Cu.
C. Zn, Fe, Al.
D. Fe, Zn, Ag
Hướng dẫn giải:
Đáp án C
Loại A, B và D vì Cu, Ag không tác dụng với H2SO4 loãng.
Ví dụ 2: Hoà tan hoàn toàn 20 gam hỗn hợp Mg và Fe bằng dung dịch HCl dư, sau phản ứng thu được 11,2 lit khí (đktc) và dung dịch X. Cô cạn dung dịch X thu được bao nhiêu gam muối khan?
A. 71,0 gam.
B. 91,0 gam.
C. 90,0 gam.
D. 55,5 gam.
Hướng dẫn giải:
Đáp án D
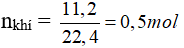
Cách 1: Tính toán theo phương trình hóa học
Gọi số mol Mg và Fe lần lượt là x và y mol
Có mhh = 24x + 56y = 20 (1)
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
x…………………x…….x mol
Fe + 2HCl → FeCl2 + H2
y………………y………y mol
Theo PTHH có: nkhí = x + y = 0,5 (2)
Từ (1) và (2) có: x = y = 0,25 mol
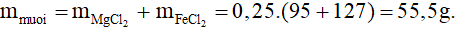
Cách 2: Áp dụng các định luật bảo toàn
Bảo toàn nguyên tố H có
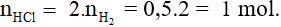
Bảo toàn khối lượng có: mKL + maxit = mmuối + mkhí
→ mmuối = 20 + 1.36,5 – 0,5.2 = 55,5 gam.
Ví dụ 3. Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư , thấy thoát ra 4,48 lít khí hiđro (ở đktc). Kim loại M là
A. Ca.
B. Mg.
C. Fe.
D. Ba.
Hướng dẫn giải:
Đáp án B
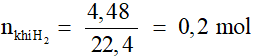
M + 2HCl → MCl2 + H2
0,2……………………0,2 mol
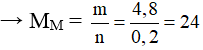
Vậy kim loại cần tìm là Mg.
III – BÀI TẬP VẬN DỤNG
Bài 1. Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36 lít H2 (đktc). Kim loại là
A. Zn.
B. Mg.
C. Fe.
D. Ca.
Lời giải:
Đáp án B
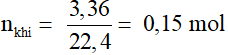
Gọi kim loại là R (hóa trị II)
R + H2SO4 (loãng) → RSO4 + H2
0,15………………………….0,15 mol
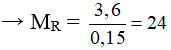
Vậy kim loại cần tìm là Magie (Mg).
Bài 2. Hoà tan 7,8 gam hỗn hợp gồm Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7 gam so với ban đầu. Số mol axit HCl đã tham gia phản ứng là
A. 0,4 mol.
B. 0,8 mol.
C. 0,04 mol.
D. 0,08 mol.
Lời giải:
Đáp án B
Cách 1: Tính toán theo phương trình hóa học
Gọi nAl = a mol và nMg = b mol
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2↑
a………3a……………..1,5a mol
Mg+ 2HCl → MgCl2 + H2↑
b……..2b………………b mol
Ta có: mdd tăng =mKL -m H2→ 7 = 7,8 – (3a + 2b)
→ 3a + 2b = 0,8 = nHCl phản ứng.
Cách 2: Sử dụng các phương pháp bảo toàn.
mđd tăng = mKL - mkhí → mkhí = 7,8 – 7 = 0,8 gam.
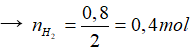
Bảo toàn nguyên tố H có naxit = 2.nkhí = 2.0,4 = 0,8 mol.
Bài 3. Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73g dung dịch HCl 10%.
Cô cạn dung dịch thu được 13,15 gam muối. Giá trị của m là
A. 7,05.
B. 5,3.
C. 4,3.
D. 6,05.
Lời giải:
Đáp án D
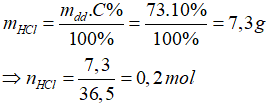
Cách 1. Tính toán theo phương trình hóa học
Đặt số mol của Zn và Fe lần lượt là x và y mol.
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2
x……2x……….x…….x mol
Fe + 2HCl → FeCl2 + H2
y……2y……..y………y mol
Theo bài ra có:
nHCl = 2x + 2y = 0,2 (1)
mmuối = 136x + 127y = 13,15 (2)
Từ (1) và (2) có x = y = 0,05
Vậy m = 0,05.(65 + 56) = 6,05 gam.
Cách 2: Áp dụng các định luật bảo toàn:
Bảo toàn nguyên tố Cl có: ngốc axit = nHCl = 0,2 mol.
mmuối = mKL + mgốc axit = m + 0,2.35,5 = 13,15 → m = 6,05 (g)
Bài 4: Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là
A. Fe.
B. Mg.
C. Cu.
D. Ag.
Lời giải:
Đáp án B
Mg + 2HCl → MgCl2 + H2
Mg + Cl2 → MgCl2.
Loại C và D do Cu và Ag không tác dụng với HCl
Loại A do:
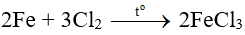
Fe + 2HCl → FeCl2 + H2.
Bài 5: Cho 1,2 gam một kim loại X có hóa trị II vào một lượng HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng lên 1,1 gam. Kim loại X là
A. Fe.
B. Mg.
C. Ba.
D. Ca.
Lời giải:
Đáp án B
X + 2HCl → XCl2 + H2

mdd↑ = mx - mkhí
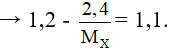
Giải phương trình được MX = 24. Vậy kim loại X là Mg.
Bài 6: Hòa tan hoàn toàn 9,65g hỗn hợp gồm Al và Fe bằng dung dịch H2SO4 loãng, dư. Sau phản ứng thu được 4,48 lít khí H2 (đktc) và m gam muối. Giá trị của m là
A. 25,88.
B. 28,58.
C. 28,85.
D. 30,85.
Lời giải:
Đáp án C
Gọi số mol của Al và Fe lần lượt là x và y mol.
Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x……..1,5x…………………..1,5x mol
Fe + H2SO4 → FeSO4 + H2
y…….y………………..y mol
Theo PTHH ta có:
Bảo toàn khối lượng có:
mmuối = mkl + mgốc axit
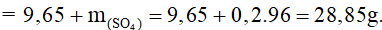
Bài 7: Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg và Zn có tỉ lệ mol tương ứng là 2:1 vào dung dịch HCl dư thấy khối lượng dung dịch A thu được tăng 10,7 gam so với dung dịch HCl ban đầu. Giá trị của m là
A. 11,8.
B. 21,5.
C. 11,3.
D. 3,5.
Lời giải:
Đáp án C
Gọi số mol Zn là a mol → số mol Mg là 2a mol
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2↑
2a……………………..2a mol
Zn + 2HCl → FeCl2 + H2↑
a……………………….a mol
Theo PTHH: nH2= 2a + a = 3a (mol)
Ta có: mdd tăng =m - mH2 = m - 6a =10,7
⇔ 2a.24 + a.65 - 6a = 10,7 ⇒ a = 0,1 mol
→ m = 10,7 + 6.0,1 = 11,3 gam.
Bài 8: Hoà tan 5,2g hỗn hợp gồm Mg và Fe bằng dung dịch axit HCl 1M, thì thu được 3,36 lit H2 (đktc). Thể tích dung dịch axit HCl đã dùng là
A. 200 ml.
B. 300 ml.
C. 400 ml.
D. 500 ml.
Lời giải:
Đáp án B
Gọi số mol của Mg và Fe lần lượt là x và y mol
Khối lượng hỗn hợp là 5,2 gam → 24x + 56y = 5,2 (1)
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
x…..2x…………………x mol
Fe + 2HCl → FeCl2 + H2
y…..2y…………………y mol
nkhí = x + y = 0,15 mol (1)
Theo PTHH có: nHCl = 2x + 2y = 2.nkhí = 0,3 mol
→ VHCl = 0,3/1 = 0,3 lít = 300 ml.
Bài 9: Hoà tan hoàn toàn 3,9 gam hỗn hợp gồm Mg và kim loại R có tỉ lệ mol tương ứng là 1:2 cần 200 ml dung dịch HCl 2M. Kim loại R và thành phần % khối lượng của nó trong hỗn hợp là
A. Zn; 78,9%.
B. Cr; 79,76%.
C. Fe; 80,25%.
D. Al; 69,23%.
Lời giải:
Đáp án D
Mg + 2HCl → MgCl2 + H2
x.......2x mol
2R + 2nHCl → 2RCln + nH2
2x.......2nx mol
nHCl = 0,4 mol → 2x + 2nx = 0,4 (1)
Có khối lượng hỗn hợp là 3,9 gam nên
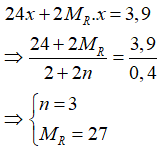
(Thỏa mãn)
Thay n = 3 vào (1) được x = 0,05 mol.
Vậy kim loại cần tìm là nhôm (2x = 0,1 mol);
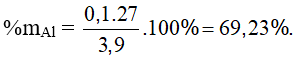
Bài 10: Thí nghiệm 1: cho a gam Fe hòa tan trong dung dịch HCl, sau khi cô cạn dung dịch thu được 3,1 gam chất rắn.
Thí nghiệm 2: cho a gam Fe và b gam Mg vào dung dịch HCl (cùng với lượng như trên) sau khi cô cạn dung dịch thì thu được 3,34g chất rắn và 448ml H2. a và b lần lượt là
A. 1,68g và 0,42g.
B. 0,42g và 1,68g.
C. 1,68g và 0,24g.
D. 0,24g và 1,68g.
Lời giải:
Đáp án C
Xét thí nghiệm 1:
Fe + 2HCl → FeCl2 + H2 (1)
Giả sử: Fe phản ứng hết. Chất rắn sau khi cô cạn chỉ có FeCl2
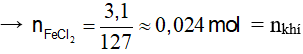
Xét thí nghiệm 2:
Mg + 2HCl → MgCl2 + H2 (2)
Fe + 2HCl → FeCl2 + H2 (3)
Ta thấy: Ngoài a gam Fe như thí nghiệm 1 cộng với b gam Mg mà chỉ giải phóng: 0,02 mol khí < 0,024 (mol)
Chứng tỏ: Trong thí nghiệm 1: Fe dư, HCl hết
Ta có:
nHCl (TN 1) = nHCl (TN 2) = 2nH2 = 2 .0,02 = 0,04 (mol)
Xét thí nghiệm 1:
nFe (pư) = nFeCl2 = .nHCl = . 0,04 = 0,02(mol)
→ mFe (dư) = 3,1 – 0,02.127 = 0,56 (gam)
→mFe = a = mFe (pư) + mFe (dư) = 0,56 + 0,02.56 = 1,68(gam)
Xét thí nghiệm 2:
Áp dụng định luật bảo toàn khối lượng:
a + b + 0,04.36,5 = 3,34 + 0,02.2 → a + b = 1,92 (g)
Mà a = 1,68g vậy b = 1,92 - 1,68 = 0,24 (g).
Xem thêm các dạng bài tập Hóa học lớp 9 chọn lọc, có lời giải chi tiết hay khác:
- Bài tập Phản ứng trao đổi trong hóa học vô cơ có lời giải
- Bài tập Kim loại tác dụng với muối có lời giải
- Bài tập Kim loại tác dụng với nước có lời giải
- Bài tập về Nhôm và hợp chất của nhôm có lời giải
- Bài tập về Sắt và hợp chất của sắt có lời giải
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k10 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều









