Các dạng bài tập Hydrocarbon; Nhiên liệu (có lời giải)
Tổng hợp Lý thuyết và các dạng bài tập Hydrocarbon; Nhiên liệu lớp 9 với phương pháp giải chi tiết và bài tập đa dạng có lời giải giúp bạn nắm vững kiến thức trọng tâm và biết cách làm bài tập Hóa học 9.
Các dạng bài tập Hydrocarbon; Nhiên liệu (có lời giải)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Lý thuyết & bài tập trắc nghiệm Hydrocarbon; Nhiên liệu
- Lý thuyết Khái niệm về hợp chất hữu cơ và hóa học hữu cơ (hay, chi tiết)
- Trắc nghiệm Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Bài tập trắc nghiệm Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Lý thuyết Cấu tạo phân tử hợp chất hữu cơ (hay, chi tiết)
- Trắc nghiệm Cấu tạo phân tử hợp chất hữu cơ
- Bài tập trắc nghiệm Cấu tạo phân tử hợp chất hữu cơ
- Lý thuyết methane (hay, chi tiết)
- Trắc nghiệm methane
- Bài tập trắc nghiệm methane
- Lý thuyết Etilen (hay, chi tiết)
- Trắc nghiệm Etilen
- Bài tập trắc nghiệm Etilen
- Lý thuyết acetylene (hay, chi tiết)
- Trắc nghiệm Acetylene
- Bài tập trắc nghiệm acetylene
- Lý thuyết benzene (hay, chi tiết)
- Trắc nghiệm benzene
- Bài tập trắc nghiệm benzene
- Lý thuyết Dầu mỏ và khí thiên nhiên (hay, chi tiết)
- Trắc nghiệm Dầu mỏ và khí thiên nhiên
- Bài tập trắc nghiệm Dầu mỏ và khí thiên nhiên
- Lý thuyết Nhiên liệu (hay, chi tiết)
- Trắc nghiệm Nhiên liệu
- Bài tập trắc nghiệm Nhiên liệu
- Lý thuyết tổng hợp hydrocarbon - Nhiên liệu (hay, chi tiết)
- Trắc nghiệm tổng hợp hydrocarbon - Nhiên liệu
Các dạng bài tập Hydrocarbon; Nhiên liệu
- Viết công thức cấu tạo của hợp chất hữu cơ và cách giải
- Lập công thức phân tử của hợp chất hữu cơ và cách giải
- Đốt cháy hydrocarbon và cách giải bài tập
- Hydrocarbon không no tác dụng với dung dịch Brom và cách giải
- Cách nhận biết, phân biệt các hydrocarbon và cách giải
- Bài tập tổng hợp về methane và cách giải
- Bài tập tổng hợp về Etilen và cách giải
- Bài tập tổng hợp về acetylene và cách giải
- Bài tập tổng hợp về benzene và cách giải
Cách viết Công thức cấu tạo của các hợp chất hữu cơ
Lý thuyết và Phương pháp giải
Lý thuyết cần nhớ
- Các hợp chất hữu cơ có cùng công thức phân tử nhưng có cấu tạo hóa học khác nhau, dẫn tới tính chất hóa học khác nhau được gọi là các chất đồng phân của nhau.
- alkane là những hydrocarbon no mạch hở có công thức chung CnH2n+2 (n ≥ 1).
- cycloalkane là hydrocarbon không no, mạch hở chứa 1 nối đôi C=C trong phân tử, có công thức chung là CnH2n (n ≥ 2).
- alkadiene: là hydrocarbon mạch hở, chứa 2 nối đôi trong phân tử, có công thức chung là CnH2n-2 (n ≥ 3).
- alkyne là hydrocarbon mạch hở, chứa một nối ba C ≡ C trong phân tử, có công thức chung CnH2n-2 (n ≥ 3).
- hydrocarbon thơm (aren) là loại hydrocarbon trong công thức phân tử có một hay nhiều nhân bezen, đại diện cho dãy đồng đẳng aren là phân tử benzene có công thức tổng quát CnH2n-6 (n ≥ 6).
Phương pháp chung:
Bước 1: Tính độ bất bão hòa (số liên kết và vòng).
Bước 2: Viết cấu trúc mạch cacbon (không phân nhánh, có nhánh, vòng) và đưa liên kết bội (đôi, ba) vào mạch cacbon nếu có.
Bước 3: Đưa nhóm chức vào mạch cacbon (thông thường các nhóm chức chứa cacbon thường được đưa luôn vào mạch ở bước 3). Lưu ý đến trường hợp kém bền hoặc không tồn tại của nhóm chức (ví dụ nhóm –OH không bền và sẽ bị chuyển vị khi gắn với cacbon có liên kết bội).
Bước 4: Điền số H vào để đảm bảo đủ hóa trị của các nguyên tố, sau đó xét đồng phân hình học nếu có. Chú ý với các bài tập trắc nghiệm có thể không cần điền số nguyên tử H.
♦ Xác định độ bất bão hõa của hợp chất hữu cơ CxHyOzNtXv theo công thức:
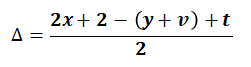
Chú ý:
-Công thức tính ở trên chỉ áp dụng cho hợp chất cộng hóa trị.
-Các nguyên tố hóa trị II như oxi, lưu huỳnh không ảnh hưởng tới độ bất bão hòa.
Bài tập tự luyện
Bài 1: Hợp chất C5H10 có bao nhiêu đồng phân cấu tạo của alkene?
Lời giải:
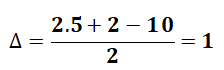
Vì C5H10 là alkene nên C5H10 là mạch hở, có 1 liên kết pi.
Có 5 đồng phân alkene của C5H10
CH3-CH2-CH2-CH=CH2
CH3-CH2-CH=CH-CH3
CH3-CH2-C(CH3)=CH2
CH3-CH=C(CH3)-CH3
CH3-CH(CH3)-CH=CH2
Bài 2: Có bao nhiêu đồng phân cấu tạo có công thức phân tử C6H14?
Lời giải:
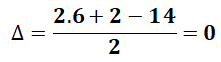
⇒ alkane ⇒ Chỉ có liên kết đơn
Vậy C6H14 chỉ có 5 đồng phân cấu tạo.
CH3-CH2-CH2-CH2-CH2-CH3
CH3-CH(CH3)-CH2-CH2-CH3
CH3-CH2-CH(CH3)-CH2-CH3
CH3-CH(CH3)-CH(CH3)-CH3
CH3-C(CH3)2-CH2-CH3
Cách lập công thức phân tử hợp chất hữu cơ
Lý thuyết và Phương pháp giải
Để giải dạng bài này, đầu tiên ta cần xác định hợp chất hữu cơ cần tìm có những nguyên tố gì, sau đó tùy theo đề bài để giải bài toán.
Giả thiết bài toán:
Đốt cháy a (gam) hợp chất hữu cơ A thu được m (g) CO2, m (g) H2O và m (g) N2 (nếu có). Tính M khối lượng mol của A (mA) yêu cầu lập công thức phân tử của A.
Các bước lập công thức phân tử:
Bước 1: Định lượng các nguyên tố trong A.
- Tìm C: Dựa vào CO2
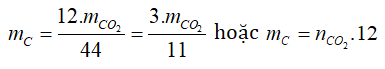
- Tìm H: Dựa vào H2O.
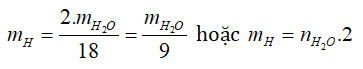
- Tìm N: Dựa vào N2.
mN = mN2 hoặc mN = nN2.28
- Tìm O: Dùng phương pháp loại suy.
mO = a - (mC + mH + mN)
Bước 2: Tính khối lượng phân tử gần đúng của hợp chất hữu cơ.
- Dựa vào tỉ khối hơi:
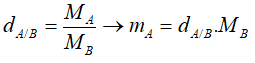
Nếu B là không khí thì MB = 29.
- Dựa vào số mol và khối lượng:
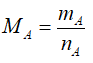
Bước 3: Lập công thức phân tử của A.
- Ở bước này, ta có 3 cách để lập công thức phân tử của A.
● Cách 1: Dựa vào thành phần khối lượng của các nguyên tố trong phân tử hợp chất hữu cơ. Đối với cách này thường phổ biến đối với bài toán cơ bản cho trước MA.
Ta có công thức tổng quát CxHyOzNt.
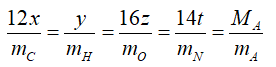
Hoặc nếu bài toán cho phần trăm khối lượng của các %C ta có công thức:
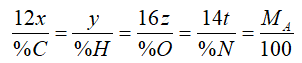
Thay các giá trị đã biết vào công tác thức trên suy ra các giá trị x, y, z, t, sau đó thay vào CTTQ ta được công thức phân tử cần lập.
● Cách 2: Lập công thức phân tử qua công thức thực nghiệm. Đối với cách này thường dùng để giải các bài toán mà yêu cầu lập công thức nguyên hay bài toán cho thiếu giả thiết để tính MA.
Trước tiên ta lập tỷ lệ số nguyên tử giữa các nguyên tố
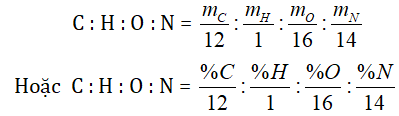
= a : b : c : d (là tỉ lệ số nguyên, tối giản)
Suy ra công thức thực nghiệm (CaHbOcNd)n.
Trong đó n ≥ 1 (là số nguyên): gọi là hệ số thực nghiệm.
Dựa vào MA hoặc giả thiết của đề cho suy ra n, thay vào công thức thực nghiệm suy ra công thức phân tử cần lập.
● Cách 3: Dựa vào phương trình cháy.
Giáo viên hướng dẫn cho học sinh phương trình cháy tổng quát nhất và cách điền số vào phương trình.
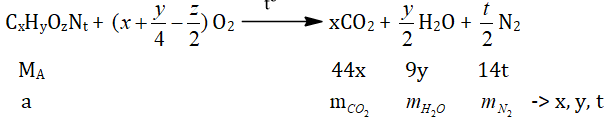
Sau đó dựa vào MA = 12x + y + 16z + 14t → Z
Bài tập tự luyện
Bài 1: Phân tử hợp chất hữu cơ A có 2 nguyên tố. Đốt cháy hoàn toàn 3 gam chất A thu được 5,4 gam nước. Hãy xác định công thức phân tử của A. Biết khối lượng mol của A là 30 gam.
Lời giải:
Cách 1
Hợp chất hữu có A có 2 nguyên tố, khi đốt cháy thu được nước
→ A chứa 2 nguyên tố C và H
nH2O = 5,4/18 = 0,3 mol
→ nH = 2. 0,3 = 0,6 mol → mH = 0,6 gam
→ mC = 3 - 0,6 = 2,4 gam → nC = 2,4/12= 0,2 mol
→ nC : nH = 0,2 : 0,6 = 1 : 3
→ Công thức đơn giản nhất của A là (CH3)n
Mà MA = 30 → 15n = 30 → n = 2
→ CTPT của A là C2H6
Cách 2
A là chất hữu cơ nên trong A phải chứa nguyên tố C.
Khi đốt cháy A thu được nước → trong A phải có H
Mặt khác A chứa 2 nguyên tố nên A có công thức CxHy
nA = 3/30 = 0,1 ml; nH2O = 5,4/18 = 0,3 mol
4 CxHy + O2 → 4x CO2 + 2y H2O
4.…………………………………2y
0,1………………………………0,3
→ 0,1.2y = 4.0,3 → y = 6
Mặt khác 12x+y = 30 → 12x + 6 = 30 → x = 2
→ CTPT của A là: C2H6
Bài 2: Đốt cháy 3 gam một chất hữu cơ A thu được 6,6 gam CO2 và 3,6 gam H2O. Xác định công thức phân tử của A, biết khối lượng mol phân tử của A là 60 gam
Lời giải:
nCO2 = 6,6/44=0,15 mol; nH2O = 3,6/18 = 0,2 mol
→ nC = 0,15 mol; nH = 0,2.2 = 0,4 mol→ mC = 12.0,15 = 1,8 gam; mH = 0,4.1 = 0,4 gam
→ mC + mH = 1,8 + 0,4 = 2,2 gam < mA
→ Trong A còn có O (vì khi đốt cháy chỉ thu được CO2 và H2O)
→ mO = 3 – (mC + mH) = 3 – 2,2 = 0,8 mol → nO = 0,8/16 = 0,05 mol
→ nC : nH : nO = 0,15 : 0,4 : 0,05 = 3 : 8 :1
→ Công thức đơn giản nhất của A là (C3H8O)n
MA = 60 → 60n = 60 → n = 1
→ CTPT của A là C3H8O
Cách giải Bài toán đốt cháy hydrocarbon?/strong>
Lý thuyết và Phương pháp giải
Hydrocarbon CxHy hoặc CnH2n+2-2k (n ≥ 1, 𝑘 ≥ 0)
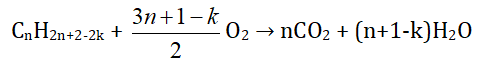
* Dựa vào sản phẩm của phản ứng đốt cháy hydrocarbon:
- nH2O > nCO2 ⇒ CTPT CnH2n+2 và nCnH2n+2 = nH2O - nCO2
- nH2O = nCO2 ⇒ CTPT CnH2n
- nH2O < nCO2 ⇒ CTPT CnH2n-2 và nCnH2n-2 = nCO2 - nH2O
* Thường áp dụng ĐLBT nguyên tố và bảo toàn khối lượng:
BTKL: mCxHy + mO2 pư = mCO2 + mH2O
BTNT:
nC(CxHy) = nC(CO2)
nH(CxHy) = nH(H2O)
⇒ mCxHy pư = mC + mH = 12.nCO2 + 2. nH2O
nO2 pư = nCO2 + 1/2 nH2O
* Một số công thức cần nhớ:
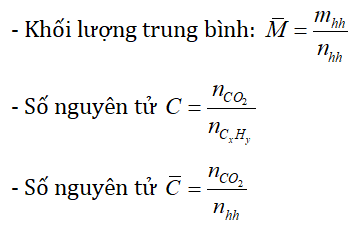
Chú ý:
- Nếu cho sản phẩm cháy thu được dẫn qua bình (1) đựng chất hấp thụ H2O: P2O5, H2SO4 đặc, CaCl2…bình (2) đựng chất hấp thụ CO2 như: NaOH, KOH, Ca(OH)2, Ba(OH)2…
Khi đó:
Khối lượng bình (1) tăng = mH2O
Khối lượng bình (2) tăng = mCO2
- Nếu cho toàn bộ sản phẩm cháy qua dung dịch Ca(OH)2, Ba(OH)2 thì khối lượng bình tăng = mCO2 +mH2O. Khi đó khối lượng dung dịch tăng hoặc giảm so với khối lượng dung dịch ban đầu.
+ Khối lượng dung dịch tăng: Δ𝑚𝑑𝑑 ↑ = (mCO2+mH2O) - m↓
+ Khối lượng dung dịch giảm: Δ𝑚𝑑𝑑 ↓ = m↓ -( mCO2+mH2O)
Bài tập tự luyện
Bài 1: Khi đốt hoàn toàn 3 gam một hợp chất hữu cơ A thu được 8,8 gam CO2 và 5,4 gam H2O
a) Trong A có chứa những nguyên tố nào?
b) Biết phân tử khối của A nhỏ hơn 40. Xác định công thức phân tử của A?
c) A có làm mất màu dung dịch brom không?
Lời giải:
a)
→ mO = 3 – (mC + mH) = 3 – 2,4 – 0,6 = 0
→ A chỉ chứa 2 nguyên tố C và H
b)
nC : nH = 0,2 : 0,6 = 1 : 3
→ Công thức đơn giản nhất của A: (CH3)n
MA < 40 → 15n < 40 → n < 2,67 → n chỉ có thể là 1 hoặc 2
TH 1: n = 1 → Công thức phân tử của A là CH3 ( Loại)
TH 2: n = 2 → Công thức phân tử của A là C2H6 ( thỏa mãn)
c) C2H6 không làm mất màu dung dịch brom
Bài 2: Đốt cháy hoàn toàn 0,15 mol hỗn hợp A gồm 2 hydrocarbon no thu được 9,45g H2O. Cho sản phẩm cháy vào dung dịch Ca(OH)2 dư thì khối lượng kết tủa thu được là bao nhiêu?
Lời giải:
nH2O = 9,45/18 = 0,525 mol
nA = nH2O – nCO2 ⇒ nCO2 = nH2O – nA =0,525-0,15 = 0,375 mol
nCaCO3 = nCO2 = 0,375 mol
⇒ mCaCO3 = 0,375.100 = 37,5g
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm cách giải các dạng bài tập Hóa học lớp 9 hay, chi tiết khác:
- Các dạng bài tập Các loại hợp chất vô cơ
- Các dạng bài tập Kim loại
- Các dạng bài tập Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Các dạng bài tập Dẫn xuất của hydrocarbon; polymer
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

