Tổng hợp các dạng bài tập Hóa học lớp 9 có lời giải chi tiết
Tổng hợp các dạng bài tập Hóa học lớp 9 có lời giải chi tiết
Với môn Hóa học lớp 9, học sinh sẽ được làm quen với nhiều chất hóa học, khái niệm, công thức, ... nền tảng của môn Hóa học. Tài liệu tổng hợp các dạng bài tập Hóa học lớp 9 với đầy đủ phương pháp giải chi tiết, các bài tập tự luyện đa dạng ở nhiều mức độ giúp bạn biết cách giải các dạng bài tập môn Hóa học lớp 9 từ đó ôn tập và đạt điểm cao trong bài thi môn Hóa học 9.
- Bài tập Chuỗi phản ứng hóa học vô cơ có lời giải
- Bài tập Nhận biết, phân biệt các chất vô cơ có lời giải
- Bài tập Oxit bazo tác dụng với axit có lời giải
- Bài tập Oxit axit tác dụng với bazo có lời giải
- Bài tập Axit tác dụng với bazo có lời giải
- Bài tập Muối tác dụng với muối có lời giải
- Bài tập Axit tác dụng với muối có lời giải
- Bài tập Muối tác dụng với bazo có lời giải
- Bài tập Phản ứng trao đổi trong hóa học vô cơ có lời giải
- Bài tập Kim loại tác dụng với axit có lời giải
- Bài tập Kim loại tác dụng với muối có lời giải
- Bài tập Kim loại tác dụng với nước có lời giải
- Bài tập về Nhôm và hợp chất của nhôm có lời giải
- Bài tập về Sắt và hợp chất của sắt có lời giải
- Bài tập Khử oxit kim loại bằng C hoặc CO có lời giải
- Bài tập CO2 tác dụng với dung dịch kiềm có lời giải
- Bài tập Clo và hợp chất của clo có lời giải
- Bài tập về Hợp chất của cacbon có lời giải
- Bài tập về Bảng tuần hoàn các nguyên tố hóa học có lời giải
- Bài tập Viết công thức cấu tạo của hợp chất hữu cơ có lời giải
- Bài tập Lập công thức phân tử của hợp chất hữu cơ có lời giải
- Bài tập về methane có lời giải
- Bài tập về Etilen có lời giải
- Bài tập về Axetilen có lời giải
- Bài tập về Benzen có lời giải
- Bài tập về rượu Etylic có lời giải
- Bài tập về Độ rượu có lời giải
- Bài tập về Axit axetic có lời giải
- Bài tập về Hiệu suất phản ứng este hóa có lời giải
- Bài tập về Thủy phân chất béo có lời giải
- Bài tập về Glucozo có lời giải
- Bài tập về Saccarozo có lời giải
- Bài tập về Tinh bột và xenlulozo có lời giải
Bài tập Oxit bazo tác dụng với axit có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Oxit bazơ tác dụng với axit (HCl; H2SO4 loãng …) tạo thành muối và nước.
Ví dụ:
FeO + H2SO4 loãng → FeSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
- Thông thường dùng phương pháp tính toán theo PTHH để giải bài tập:
+ Bước 1: Viết phương trình hóa học xảy ra.
+ Bước 2: Đặt các dữ kiện vào phương trình hóa học (có thể phải đặt ẩn, hoặc xác định chất dư theo từng bài).
+ Bước 3: Tính toán theo yêu cầu của đề bài.
- Ngoài ra, để giải toán có thể phối hợp áp dụng các phương pháp:
+ Bảo toàn khối lượng;
+ Tăng giảm khối lượng;
+ Bảo toàn nguyên tố;
+ Quy đổi …
- Một số phương trình thường gặp cần lưu ý:
2FeO + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O
2Fe3O4 + 10H2SO4 đặc → 3Fe2(SO4)3 + SO2 + 10H2O
II – VÍ DỤ MINH HỌA
Ví dụ 1: Cho 3,825 gam một oxit kim loại (trong đó kim loại có hóa trị II) tác dụng với dung dịch H2SO4 loãng, vừa đủ. Sau khi phản ứng kết thúc thu được dung dịch chứa 5,825 gam muối. Công thức hóa học của oxit là?
A. BaO.
B. CuO.
C. FeO.
D. CaO.
Hướng dẫn:
Đáp án A
Đặt oxit cần tìm là MO. Phương trình hóa học xảy ra:
MO + H2SO4 → MSO4 + H2O
Theo bài ra ta có:
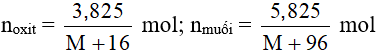
Theo PTHH có:
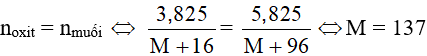
Vậy M là bari (Ba). Oxit cần tìm là BaO.
Ví dụ 2: Cho 8 (gam) CuO vào cốc chứa 20 gam dung dịch hydrochloric acid 7,3%. Đến khi phản ứng xảy ra hoàn toàn, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 6,75 gam.
B. 13,50 gam.
C. 5,40 gam.
D. 2,7 gam.
Hướng dẫn:
Đáp án D.
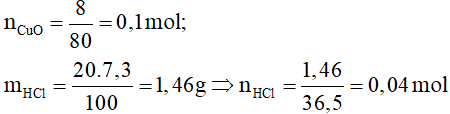
Phương trình hóa học:
CuO + 2HCl → CuCl2 + H2O
0,1 0,04 mol
Có
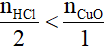
vậy sau phản ứng HCl hết; số mol CuCl2 tính theo số mol HCl.
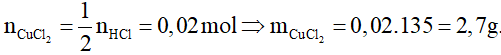
Ví dụ 3: Cho 2,8g hỗn hợp CuO, MgO, Fe2O3 tác dụng vừa đủ với 50 ml dd H2SO4 1M. Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
A. 4,5g.
B. 7,6g.
C. 6,8g.
D. 7,4g.
Hướng dẫn:
Đáp án C.
Bảo toàn khối lượng:
mhh oxit + mH2SO4 = mmuối + mnước sinh ra
Bảo toàn nguyên tố H có: nnước sinh ra = nH2SO4
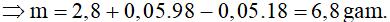
....................................
....................................
....................................
Bài tập Oxit axit tác dụng với bazo có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ:
1/ CO2 + Ca(OH)2 → CaCO3↓ + H2O
(Nếu CO2 dư tiếp tục có phản ứng: CO2 + CaCO3 + H2O → Ca(HCO3)2)
2/ CO2 + 2NaOH → Na2CO3 + H2O
(Nếu CO2 dư tiếp tục có phản ứng: CO2 + Na2CO3 + H2O → 2NaHCO3)
- Thông thường các oxit axit thường gặp trong chương trình là CO2 và SO2. Lưu ý, khi cho SO2 hoặc CO2 vào dung dịch kiềm tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối trung hòa, muối axit hoặc hỗn hợp cả hai muối.
- Phương pháp giải:
Bước 1: Tính toán các số mol theo dữ kiện đề bài.
Bước 2: Xác định sản phẩm thu được sau phản ứng (dựa vào tỉ lệ mol; hoặc dữ kiện đề bài cho).
Bước 3: Viết các phương trình hóa học xảy ra (nếu cần thiết).
Bước 4. Tính toán theo yêu cầu đề bài (nếu có).
- Chú ý cách xác định sản phẩm phản ứng dựa vào tỉ lệ số mol:
Bài toán 1: Dẫn khí CO2 hoặc SO2 vào dung dịch NaOH; KOH … (kim loại trong bazơ có hóa trị I)
Đặt
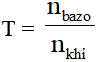
+ Nếu T = 2: Sau phản ứng chỉ thu được muối trung hòa, các chất tham gia phản ứng đều hết.
+ Nếu T > 2: Sau phản ứng thu được muối trung hòa, bazơ dư.
+ Nếu T = 1: Sau phản ứng chỉ thu được muối axit, các chất tham gia phản ứng đều hết.
+ Nếu T < 1: Sau phản ứng thu được muối axit, oxit axit dư.
+ Nếu 1 < T < 2: Sau phản ứng thu được hỗn hợp 2 loại muối, các chất tham gia phản ứng đều hết.
Bài toán 2: Dẫn khí CO2 hoặc SO2 vào dung dịch Ca(OH)2 ; Ba(OH)2 … (kim loại trong bazơ có hóa trị II)
Đặt
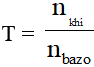
+ Nếu T = 2: Sau phản ứng thu được muối axit; các chất tham gia phản ứng đều hết.
+ Nếu T > 2: Sau phản ứng chỉ thu được muối axit; oxit axit dư.
+ Nếu T = 1: Sau phản ứng chỉ thu được muối trung hòa; các chất tham gia phản ứng đều hết.
+ Nếu T < 1: Sau phản ứng chỉ thu được muối trung hòa; bazơ dư.
+ Nếu 1 < T < 2: Sau phản ứng thu được hỗn hợp 2 loại muối; các chất tham gia phản ứng đều hết.
Lưu ý:
+ Nếu đề bài cho rõ bazơ dư, không cần tính T xác định muối thu được chỉ có muối trung hòa.
+ Nếu đề bài cho rõ oxit axit dư, không cần tính T xác định muối thu được chỉ có muối axit.
II. MỘT SỐ VÍ DỤ MINH HỌA
Ví dụ 1: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào dung dịch nước vôi trong có chứa 0,075 mol Ca(OH)2. Sau phản ứng thu được
A. CaCO3.
B. Ca(HCO3)2.
C. CaCO3 và Ca(HCO3)2.
D. CaCO3 và Ca(OH)2 dư.
Hướng dẫn:
Đáp án C
Đặt
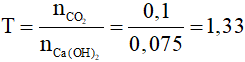
Có 1 < T < 2, sau phản ứng thu được 2 muối CaCO3 và Ca(HCO3)2.
Ví dụ 2: Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là
A. 19,7 gam.
B. 9,85 gam.
C. 1,97 gam.
D. 17,9 gam.
Hướng dẫn:
Đáp án A
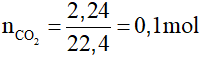
Do Ba(OH)2 dư nên sản phẩm thu được là muối trung hòa:
Phương trình hóa học:
CO2 + Ba(OH)2 dư → BaCO3 ↓ + H2O
0,1…………………..0,1 mol
→ m↓ = 0,1.197 = 19,7 gam.
....................................
....................................
....................................
Bài tập Muối tác dụng với muối có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Phản ứng xảy ra giữa hai dung dịch muối thường là phản ứng trao đổi. Hai dung dịch muối có thể tác dụng với nhau để tạo thành hai muối mới.
Dung dịch muối 1 + Dung dịch muối 2 → 2 muối mới.
Ví dụ:
BaCl2 + CuSO4 → BaSO4 ↓ + CuCl2
NaCl + AgNO3 → AgCl↓ + NaNO3
- Điều kiện để xảy ra phản ứng trao đổi giữa hai dung dịch muối:
+ Hai muối tham gia phản ứng phải tan.
+ Sản phẩm tạo thành phải có kết tủa hoặc chất dễ bay hơi.
- Phương pháp giải:
Bước 1: Tính các số mol của các chất mà đề bài cho dữ kiện (hoặc đặt ẩn tùy theo từng bài).
Bước 2. Viết các phương trình hoá học xảy ra.
Bước 3. Xác định chất dư (nếu có) và tính toán theo yêu cầu của đề bài.
Ngoài ra có thể phối hợp áp dụng định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố, ... để giải quyết bài toán.
- Một số phản ứng giữa hai muối nhưng không là phản ứng trao đổi, cần lưu ý:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2 ↑
II – MỘT SỐ VÍ DỤ MINH HỌA
Ví dụ 1. Dãy gồm các muối tác dụng với dung dịch BaCl2 là
A. Na2CO3, Na2SO3, NaCl.
B. Na2SO4; K2CO3; AgNO3.
C. CaCO3, Na2CO3, MgCl2.
D. AgNO3, Na2CO3, Cu(NO3)2.
Hướng dẫn giải
Đáp án B
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
BaCl2 + K2CO3 → BaCO3 ↓ + 2KCl
BaCl2 + 2AgNO3 → 2AgCl ↓ + Ba(NO3)2.
Ví dụ 2: Cho 20ml dung dịch NaCl 1M vào lượng dư dung dịch AgNO3. Đến khi phản ứng xảy ra hoàn toàn khối lượng kết tủa tạo thành là
A. 28,7 gam.
B. 2,87 gam.
C. 27,8 gam.
D. 2,78 gam.
Hướng dẫn giải
Đáp án B
Ta có: nNaCl = 0,02.1 = 0,02 mol
Phương trình phản ứng:
NaCl + AgNO3 → NaNO3 +AgCl ↓
0,02 …………………………0,02 (mol)
Khối lượng kết tủa tạo thành:
mAgCl = 0,02.(108 + 35,5) = 2,87 (g)
....................................
....................................
....................................
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k10 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều









