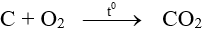Bài tập Nhận biết, phân biệt các chất vô cơ có lời giải
Tài liệu Bài tập Nhận biết, phân biệt các chất vô cơ có lời giải Hóa học lớp 9 với đầy đủ phương pháp giải chi tiết, các bài tập tự luyện đa dạng ở nhiều mức độ giúp bạn biết cách giải các dạng bài tập môn Hóa học lớp 9 từ đó ôn tập và đạt điểm cao trong bài thi môn Hóa học 9.
Bài tập Nhận biết, phân biệt các chất vô cơ có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Để nhận biết, phân biệt được các hợp chất vô cơ học sinh cần phải nắm được dấu hiệu nhận ra hợp chất (màu sắc, độ tan …) cũng như là tính chất hóa học của nó.
- Phản ứng hoá học được chọn để nhận biết là phản ứng đặc trưng đơn giản và có dấu hiệu rõ rệt.
- Tất cả các chất được lựa chọn dùng để nhận biết, phân biệt các hoá chất theo yêu cầu của đề bài, đều được coi là thuốc thử.
- Dưới đây là bảng dấu hiệu nhận biết một số hợp chất vô cơ thường gặp:
∗ MỘT SỐ THUỐC THỬ NHẬN BIẾT DUNG DỊCH
Hoá chất |
Thuốc thử |
Hiện tượng |
Phương trình minh hoạ |
|
|
- Dd axit - Dd bazơ (kiềm) |
Quỳ tím |
- Dd xit làm quỳ tím hoá đỏ. - Dd bazơ làm quỳ tím hoá xanh. |
||
Dd muối sunfat hoặc H2SO4 |
- BaCl2 - Ba(OH)2 |
Tạo kết tủa trắng không tan trong axit mạnh |
H2SO4 + BaCl2 →BaSO4+ 2HCl Na2SO4 + Ba(OH)2 → BaSO4+ 2NaOH |
|
Dd muối sunfit. |
- BaCl2 - Axit |
- Tạo kết tủa trắng. - Tạo khí không màu, mùi hắc. |
Na2SO3 + BaCl2 → BaSO3+ 2NaCl Na2SO3 + 2HCl → BaCl2 + SO2 ↑+ H2O |
|
Dd muối carbonate |
- Axit - BaCl2 |
-Tạo khí không màu. -Tạo kết tủa trắng. |
CaCO3 +2HCl→ CaCl2 + CO2 ↑+ H2O Na2CO3 + BaCl2 → BaCO3 ↓+ 2NaCl |
|
Dd muối photphat |
AgNO3 |
- Tạo kết tủa màu vàng |
Na3PO4+ 3AgNO3 → Ag3PO4↓ + 3NaNO3 |
|
Dd muối clorua hoặc HCl |
AgNO3 |
Tạo kết tủa trắng |
HCl + AgNO3 → AgCl↓ + HNO3 NaCl + AgNO3 → AgCl↓ + NaNO3 |
|
Dd muối sunfua |
Pb(NO3)2 |
Tạo kết tủa đen. |
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3 |
|
Dd muối sắt (II) |
Dung dịch kiềm (NaOH; KOH ...) |
Tạo kết tủa trắng xanh, sau đó bị hoá nâu ngoài không khí. |
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl 4Fe(OH)2 + O2 + 2H2O →4Fe(OH)3 ↓ |
|
Dd muối sắt (III) |
Tạo kết tủa màu nâu đỏ |
FeCl3 + 3NaOH →Fe(OH)3 ↓ + 3NaCl |
||
Dd muối magie |
Tạo kết tủa trắng |
MgCl2 + 2NaOH→ Mg(OH)2 ↓ + 2NaCl |
||
Dd muối đồng |
Tạo kết tủa xanh lam |
Cu(NO3)2 + 2NaOH →Cu(OH)2 ↓ + 2NaNO3 |
||
Dd muối nhôm |
Tạo kết tủa trắng, tan trong kiềm dư |
AlCl3 + 3NaOH →Al(OH)3 ↓+ 3NaCl Al(OH)3 + NaOH (dư) →NaAlO2 + 2H2O |
||
∗ NHẬN BIẾT CHẤT KHÍ
KHÍ |
THUỐC THỬ |
HIỆN TƯỢNG |
PHƯƠNG TRÌNH HÓA HỌC MINH HỌA |
|
1. |
SO2 |
- dd Br2 - dd KMnO4 |
- Mất màu nâu đỏ - Mất màu tím |
SO2 + Br2 + 2H2O → 2HBr + H2SO4 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 . |
2. |
H2S |
- Pb(NO3)2 - Cu(NO3)2 - dd Br2 - dd KMnO4 |
- ↓ đen - ↓ đen - Mất màu nâu đỏ - Mất màu tím |
H2S + Pb(NO3)2 → PbS↓ + 2HNO3 H2S + Cu(NO3)2 → CuS↓ + 2HNO3 H2S + 4Br2 + 4H2O → 8HBr + H2SO4 5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O |
3. |
CO2 |
- nước vôi trong dư - Ba(OH)2 dư |
↓trắng |
CO2 + Ca(OH)2 → CaCO3↓ + H2O CO2 + Ba(OH)2 → BaCO3↓ + H2O |
| 4. |
NH3 |
- Quỳ tím ẩm - Axit HCl đậm đặc |
- Hóa xanh - Khói trắng |
NH3 (k) + HCl(k) → NH4Cl(r) |
5. |
HCl |
- Quỳ tím ẩm - Dd AgNO3 |
- Hóa đỏ - ↓trắng |
AgNO3 + HCl → AgCl ↓ + HNO3 |
6. |
CO |
CuO, to |
CuO đen đỏ, khí bay ra làm đục dd Ca(OH)2 |
CuO (đen) + CO CO2 + Ca(OH)2 → CaCO3↓ + H2O |
7. |
Cl2 |
- Quỳ tím ẩm - dd KI, hồ tinh bột. |
- Quỳ tím ẩm chuyển đỏ sau đó mất màu - Làm xanh hồ tinh bột |
-Cl2 + H2O⇄ HCl + HClO Lúc đầu quỳ tím chuyển đỏ sau đó nhanh chóng mất màu do tác dụng tẩy màu của HClO -Cl2 + 2KI → 2KCl + I2 I2 sinh ra làm xanh hồ tinh bột. |
8. |
H2 |
CuO, to |
CuO đen →đỏ |
CuO (đen) + H2 |
9. |
O2 |
Que đóm còn tàn đỏ |
Que đóm bùng cháy |
|
10. |
O2 |
dd KI + hồ tinh bột |
Xanh hồ tinh bột |
O3 + 2KI + H2O → I2 + O2 + 2KOH I2 sinh ra làm xanh hồ tinh bột. |
- Bài tập nhận biết, phân biệt các chất thường gồm các bước sau:
Bước 1: Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng. (Trích mẫu thử - thông thường với chất khí có thể bỏ qua bước này).
Bước 2: Chọn thuốc thử thích hợp tuỳ theo yêu cầu đề bài (thuốc thử tuỳ chọn, hạn chế hay không dùng thuốc thử nào khác).
Bước 3: Cho thuốc thử vào các ống nghiệm ghi nhận các hiện tượng và rút ra kết luận đã nhận biết, phân biệt được hoá chất nào.
Bước 4: Viết các phương trình hóa học minh hoạ.
Chú ý: Cần phân biệt sự khác nhau giữa nhận biết và phân biệt các chất.
- Để phân biệt các chất A,B,C,D chỉ cần nhận ra các chất A, B,C chất còn lại đương nhiên là D
- Để nhận biết A, B,C,D cần phải xác định tất cả các chất, không bỏ chất nào. Vì còn một chất mà không qua kiểm chứng chưa chắc đã nhận biết được đó là chất gì.
II – MỘT SỐ VÍ DỤ MINH HỌA
Ví dụ 1: Có 4 lọ đựng 4 chất lỏng: H2SO4, HCl, HNO3, nước cất bị mất nhãn. Bằng phương pháp hoá học hãy phân biệt chúng.
Hướng dẫn:
- Đánh số thứ tự từng lọ mất nhãn. Trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho quỳ tím vào từng mẫu thử, mẫu thử nào không làm đổi màu quỳ tím thì đó là H2O.
- Dùng thuốc thử Ba(NO3)2 nhỏ vào 3 mẫu thử còn lại, mẫu nào xuất hiện kết tủa trắng là H2SO4.
PTHH: Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
- Dùng thuốc thử AgNO3 nhỏ vào 2 mẫu thử còn lại. Mẫu thử nào nào xuất hiện chất kết tủa màu trắng là HCl.
PTHH: HCl + AgNO3 → AgCl↓ +HNO3
- Mẫu thử còn lại chứa HNO3.
Ví dụ 2: Có 4 lọ hóa chất bị mất nhãn chứa các dung dịch sau: HCl, Ba(OH)2, Na2SO4, BaCl2. Chỉ dùng thêm quỳ tím hãy phân biệt các dung dịch đó.
Hướng dẫn:
- Đánh số thứ tự từng lọ mất nhãn. Trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi mẫu thử một mẩu quỳ tím:
+ Quỳ tím hóa xanh → Ba(OH)2;
+ Quỳ tím hóa đỏ → HCl;
+ Quỳ tím không đổi màu → Na2SO4; BaCl2 (nhóm I)
- Phân biệt nhóm I: Sử dụng Ba(OH)2 vừa nhận ra ở trên.
+ Xuất hiện kết tủa trắng → Na2SO4;
PTHH: Ba(OH)2 + Na2SO4 → BaSO4 ↓ + 2NaOH;
+ Không hiện tượng: BaCl2.
Ví dụ 3: Không dùng thêm hoá chất nào khác hãy nhận biết 3 lọ bị mất nhãn chứa các dung dịch sau: HCl, K2CO3 và Ba(NO3)2
Hướng dẫn:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho lần lượt các mẫu thử phản ứng với nhau ta được kết quả cho bởi bảng sau:
HCl |
K2CO3 |
Ba(NO3)2 |
|
HCl |
- |
CO2 ↑ |
- |
K2CO3 |
CO2 ↑ |
- |
BaCO3↓ |
Ba(NO3)2 |
- |
BaCO3↓ |
- |
Qua bảng ta thấy:
- Mẫu thử nào phản ứng với hai mẫu thử còn lại cho một chất khí đó là dung dịch HCl.
- Mẫu thử nào phản ứng với hai mẫu thử còn lại xuất hiện một chất kết tủa, một chất khí đó là K2CO3.
- Mẫu thử nào phản ứng với hai mẫu thử còn lại xuất hiện một kết tủa đó là Ba(NO3)2.
Các phương trình phản ứng xảy ra:
2HCl + K2CO3 → 2KCl + H2O + CO2 ↑
K2CO3 + Ba(NO3)2 → 2KNO3 + BaCO3↓
III – BÀI TẬP VẬN DỤNG
Bài 1: Bằng phương pháp hóa học hãy phân biệt hai khí SO2 và CO2.
Lời giải:
Dẫn lần lượt từng khí qua ống nghiệm đựng dung dịch brom. Khí làm mất màu nâu đỏ của brom là SO2, không làm mất màu hay nhạt màu dung dịch brom là CO2.
SO2 + Br2 + H2O→ 2HBr + H2SO4.
Bài 2: Bằng phương pháp hóa học nào có thể nhận biết được hai khí không màu, không mùi là CO2 và O2 chứa trong 2 bình riêng biệt, mất nhãn.
Lời giải:
- Đánh số thứ tự từng bình mất nhãn.
- Đưa que đóm còn tàn đỏ lần lượt vào đầu ống dẫn khí của từng bình. Nếu que đóm bùng cháy thì bình chứa khí O2.
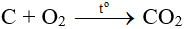
- Dẫn khí ở bình còn lại qua ống nghiệm đựng nước vôi trong, thấy xuất hiện kết tủa trắng → bình chứa CO2.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Bài 3: Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, KOH, Na2SO4, NaCl.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ: HCl
+ Quỳ tím chuyển sang màu xanh: KOH
+ Quỳ tím không đổi màu: Na2SO4, NaCl (nhóm I)
- Phân biệt nhóm I: Dùng BaCl2
+ Có kết tủa trắng: Na2SO4
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
+ Không hiện tượng: NaCl
Bài 4: Phân biệt các dung dịch sau: NaOH; HCl; BaCl2; H2SO4 chứa trong các lọ riêng biệt, mất nhãn.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím hóa xanh: NaOH
+ Quỳ tím không đổi màu: BaCl2
+ Quỳ tím hóa đỏ: HCl; H2SO4 (nhóm I)
- Phân biệt nhóm I: Sử dụng BaCl2
+ Xuất hiện kết tủa trắng: H2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
+ Không hiện tượng: HCl
Bài 5: Không sử dụng quỳ tím, phân biệt các dung dịch sau chứa trong lọ mất nhãn bằng phương pháp hóa học: HCl, NaBr, MgF2.
Lời giải:
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ vào mỗi ống nghiệm một vài giọt AgNO3.
- Ống nghiệm nào có kết tủa trắng xuất hiện là ống nghiệm chứa HCl
HCl + AgNO3 → AgCl↓ + HNO3
- Ống nghiệm nào có kết tủa vàng xuất hiện là ống nghiệm chứa NaBr
NaBr + AgNO3 → AgBr↓ + NaNO3
- Ống nghiệm nào không có hiện tượng gì là ống nghiệm chứa MgF2.
Bài 6: Không sử dụng quỳ tím, chỉ dùng thêm một hóa chất hãy phân biệt các dung dịch sau chứa trong lọ mất nhãn bằng phương pháp hóa học: HCl, NaBr, BaCl2.
Lời giải:
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Nhỏ lần lượt vào từng ống nghiệm một vài giọt Na2CO3.
+ Ống nghiệm nào có khí thoát ra là ống nghiệm chứa HCl
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
+ Ống nghiệm nào có kết tủa trắng xuất hiện là ống nghiệm chứa BaCl2.
BaCl2 + Na2CO3 → 2NaCl + BaCO3↓
+ Ống nghiệm nào không có hiện tượng xảy ra là ống nghiệm chứa NaBr.
Dán nhãn từng lọ vừa nhận biết.
Bài 7: Chỉ dùng thêm một hóa chất hãy nhận biết các lọ mất nhãn chứa các dung dịch sau: H2SO4; Na2SO4; Na2CO3; MgSO4 bằng phương pháp hóa học.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sau đó dùng thuốc thử là axit HCl nhỏ vào các mẫu thử.
Mẫu thử nào có khí thoát ra thì đó là Na2CO3 do có phản ứng:
Na2CO3 + 2HCl → NaCl + CO2 ↑ + H2O
- Sau đó dùng Na2CO3 vừa nhận ra nhỏ vào các mẫu thử còn lại,
+ Mẫu thử nào có khí thoát ra thì đó là H2SO4 do có phản ứng:
H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2 ↑
+ Mẫu thử nào xuất hiện kết tủa trắng thì đó là MgSO4 do có phản ứng:
MgSO4 + Na2CO3→ Na2SO4 + MgCO3↓
- Mẫu thử còn lại không có hiện tượng gì chính là Na2SO4.
Bài 8: Bằng phương pháp hoá học hãy phân biệt 4 lọ mất nhãn chứa các dung dịch sau: NaOH, HCl, NaCl, NaNO3.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mẫu thử.
- Tiến hành phân biệt các chất theo bảng sau:
|
Mẫu thử Thuốc thử |
NaOH |
HCl |
NaCl |
NaNO3 |
Quỳ tím |
Xanh |
Đỏ |
- |
- |
AgNO3 |
↓ trắng |
- |
(chú ý: “ – ” là không xảy ra hiện tượng gì)
- Phương trình hóa học minh họa:
AgNO3 + NaCl → AgCl↓ + NaNO3.
Bài 9: Cho 4 lọ mất nhãn đựng các dung dịch NaCl, AlCl3, MgCl2, NaOH. Chỉ dùng thêm một hóa chất là phenolphtalein hãy trình bày cách phân biệt 4 lọ.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi mẫu thử một vài giọt phenolphtalein.
+ Dung dịch chuyển sang màu hồng → NaOH
+ 3 mẫu thử còn lại không có hiện tượng gì.
- Lần lượt cho từ từ NaOH (đã nhận ra ở trên) đến dư vào ba mẫu thử còn lại.
+ Xuất hiện kết tủa trắng, kết tủa không tan khi NaOH dư → mẫu thử là MgCl2.
PTHH: 2NaOH + MgCl2 → Mg(OH)2 ↓ + 2NaCl
+ Xuất hiện kết tủa trắng, kết tủa tan khi NaOH dư → mẫu thử là AlCl3.
PTHH: 3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
Al(OH)3 + NaOH → NaAlO2 + 2H2O
+ Mẫu thử còn lại không thấy hiện tượng gì thì đó là NaCl.
Bài 10: Không dùng thêm hoá chất nào khác hãy nhận biết 4 lọ hoá chất mất nhãn chứa các dung dịch sau: BaCl2, H2SO4, Na2CO3 và ZnCl2.
Lời giải:
Trích mỗi lọ ra làm các mẫu thử khác nhau rồi lần lượt cho mẫu thử này lần lượt phản ứng với các mẫu thử còn lại ta được kết quả cho bởi bảng sau:
BaCl2 |
H2SO4 |
Na2CO3 |
ZnCl2 |
|
BaCl2 |
BaSO4↓ |
BaCO3↓ |
- |
|
H2SO4 |
BaSO4↓ |
CO2 ↑ |
- |
|
Na2CO3 |
BaCO3↓ |
CO2 ↑ |
ZnCO3↓ |
|
ZnCl2 |
- |
- |
ZnCO3↓ |
{(-) không phản ứng hoặc không có hiện tượng gì}
Qua bảng ta nhận thấy:
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại cho 2 kết tủa thì mẫu thử đó là BaCl2.
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại cho kết quả là 2 chất kết tủa và một chất khí là Na2CO3.
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại cho là một chất kết tủa và một chất khí là H2SO4.
- Mẫu thử nào phản ứng với 3 mẫu thử còn lại mà chỉ cho một kết tủa thì đó là ZnCl2.
Các phương trình phản ứng:
ZnCl2 + Na2CO3 → 2NaCl + ZnCO3↓
BaCl2 +H2SO4 → BaSO4↓ + 2HCl
Na2CO3 + H2SO4 → NaSO4 + H2O + CO2 ↑
Na2CO3 + BaCl2 → 2NaCl + BaCO3↓.
Xem thêm các dạng bài tập Hóa học lớp 9 chọn lọc, có lời giải chi tiết hay khác:
- Bài tập Chuỗi phản ứng hóa học vô cơ có lời giải
- Bài tập basic oxide tác dụng với axit có lời giải
- Bài tập acidic oxide tác dụng với bazo có lời giải
- Bài tập Axit tác dụng với bazo có lời giải
- Bài tập Muối tác dụng với muối có lời giải
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k10 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều


 Cu (đỏ) + CO2
Cu (đỏ) + CO2