Lý thuyết Nồng độ dung dịch (KHTN 8 Chân trời sáng tạo Bài 7)
Với tóm tắt lý thuyết Khoa học tự nhiên 8 Bài 7: Nồng độ dung dịch sách Chân trời sáng tạo hay nhất, ngắn gọn sẽ giúp học sinh lớp 8 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 8.
Lý thuyết Nồng độ dung dịch (KHTN 8 Chân trời sáng tạo Bài 7)
(199k) Xem Khóa học KHTN 8 CTST
I. Dung dịch
Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
Ví dụ:
Hoà tan đường vào nước được dung dịch nước đường.
Trong đó, đường là chất tan và nước là dung môi.
II. Độ tan của một chất trong nước
Độ tan của một chất trong nước là số gam tối đa chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định.
Độ tan được tính theo công thức:
Trong đó:
S là độ tan (đơn vị gam/100 gam nước);
mct là khối lượng chất tan (đơn vị gam);
mdm là khối lượng dung môi (đơn vị gam);
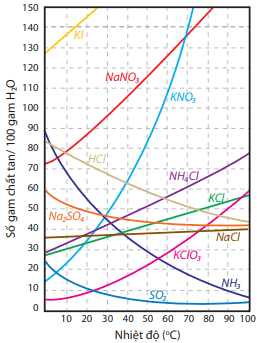
Nói chung, độ tan của chất rắn sẽ tăng khi tăng nhiệt độ (trừ một số ít trường hợp); độ tan của chất khí sẽ tăng khi giảm nhiệt độ và tăng áp suất.
Ảnh hưởng của nhiệt độ đến độ tan trong nước của một số chất rắn và chất khí được thể hiện bằng biểu đồ sau:
III. Nồng độ dung dịch
Có nhiều cách để biểu thị nồng độ dung dịch, hay sử dụng là nồng độ phần trăm và nồng độ mol.
1. Tính nồng độ phần trăm của dung dịch
Nồng độ phần trăm (kí hiệu C%) của một dung dịch là số gam chất tan có trong 100 gam dung dịch.
Công thức tính nồng độ phần trăm của dung dịch:
Trong đó:
mct: khối lượng chất tan (đơn vị gam);
mdd: khối lượng dung dịch (đơn vị gam).
Ví dụ:
Hoà tan 21 gam KNO3 vào 129 gam nước thu được dung dịch KNO3. Tính nồng độ phần trăm của dung dịch KNO3 thu được.
Hướng dẫn giải:
Khối lượng dung dịch = khối lượng dung môi + khối lượng chất tan
= 129 + 21 = 150 gam.
Nồng độ phần trăm của dung dịch KNO3 thu được là:
2. Tính nồng độ mol của dung dịch
Nồng độ mol (kí hiệu CM) của dung dịch là số mol chất tan (n) có trong 1 lít dung dịch.
Công thức tính nồng độ mol của dung dịch:
Trong đó:
n: số mol chất tan (đơn vị mol);
Vdd: thể tích dung dịch (đơn vị lít, L);
CM: nồng độ mol của dung dịch (đơn vị mol/L hoặc M).
Ví dụ:
Hoà tan 16 gam CuSO4 khan vào nước thu được 200 ml dung dịch CuSO4. Tính nồng độ mol của dung dịch CuSO4.
Hướng dẫn giải:
Số mol chất tan:
Đổi 200 ml = 0,2 lít.
Nồng độ mol của dung dịch CuSO4 là:
IV. Pha chế dung dịch
Để pha chế một dung dịch có nồng độ cho trước, ta cần phải biết lượng chất tan (khối lượng hay số mol) cần dùng để hoà tan trong một lượng dung môi.
Ví dụ 1: Pha chế 50 gam dung dịch CaCl2 có nồng độ 10%.
Hướng dẫn:
Dụng cụ và hoá chất: 1 cốc thuỷ tinh, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, calcium chloride (CaCl2) khan, nước cất.
Tính toán:
- Tìm khối lượng chất tan:
- Tìm khối lượng dung môi (nước):
mdm = mdd – mct = 50 – 5 = 45 (gam).
Cách pha chế:
- Cân lấy 5 gam CaCl2 khan (màu trắng) cho vào cốc có dung tích 100 mL.
- Cân lấy 45 gam (hoặc đong lấy 45 mL) nước cất.
- Rót nước vào cốc và khuấy nhẹ, ta thu được 50 gam dung dịch CaCl2 10%.
Ví dụ 2: Từ muối ăn NaCl, nước cất và các dụng cụ cần thiết. Hãy tính toán và nêu cách pha chế 100 mL dung dịch NaCl có nồng độ 1 M.
Hướng dẫn:
Dụng cụ và hoá chất: 1 ống đong có dung tích 150 mL, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, muối ăn, nước cất.
Tính toán:
Số mol chất tan: nNaCl = 0,1 × 1 = 0,1 (mol);
Khối lượng của 0,1 mol NaCl: mNaCl = 0,1 × 58,5 = 5,85 (gam).
Cách pha chế:
- Cân lấy 5,85 gam NaCl cho vào ống đong có dung tích 150 mL.
- Rót từ từ nước cất vào ống đong và khuấy nhẹ cho đủ 100 mL dung dịch, ta thu được 100 mL dung dịch NaCl.
(199k) Xem Khóa học KHTN 8 CTST
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay khác:
Xem thêm các tài liệu học tốt lớp 8 hay khác:
- Giải sgk Khoa học tự nhiên 8 Chân trời sáng tạo
- Giải SBT KHTN 8 Chân trời sáng tạo
- Giải lớp 8 Chân trời sáng tạo (các môn học)
- Giải lớp 8 Kết nối tri thức (các môn học)
- Giải lớp 8 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải KHTN lớp 8 Chân trời sáng tạo của chúng tôi được biên soạn bám sát nội dung và hình ảnh sách giáo khoa Khoa học tự nhiên 8 Chân trời sáng tạo (NXB Giáo dục).
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

