Bí quyết làm bài thi Tốt nghiệp THPT môn Hóa học năm 2024 đạt điểm cao
Bí quyết làm bài thi Tốt nghiệp THPT môn Hóa học năm 2024 đạt điểm cao
Phương pháp làm bài thi trắc nghiệm môn Hóa học
Đề thi trắc nghiệm THPT quốc gia năm 2017 kiểm tra các kiến thức và kĩ năng thuộc chương trình lớp 12, sắp xếp từ dễ đến khó theo 4 mức độ: nhận biết(1), thông hiểu (2), vận dụng (3) và vận dụng cao (4)
Để làm được bài thi trắc nghiệm môn Hóa học được điểm cao, chúng ta phải làm tốt tất cả các mức độ không là sai các câu mức độ (1) và mức độ (2), làm được các câu mức độ (3) và mức độ (4). Vì năm 2017 cho thời gian làm bài rất ngắn (50 phút cho 40 câu) nên thời gian là vấn đề các em phải hết sức quan tâm. Vậy làm thế nào cho kịp thời gian. Bây giờ chúng ta xem xét từng mức độ và sắp xếp thời gian cho mỗi mức độ trong kì thi THPT quốc gia năm 2017
1. Mức độ (1): Đây là mức độ dễ nhất, được sắp xép trên cùng. Mức độ này yêu cầu HS nhớ được các kiến thức cơ bản nhất, chủ yếu là các câu lí thuyết và có 12 câu trong đề thi Tốt nghiệp THPT 2017
Ví dụ: Chất nào sau đây còn có tên gọi là đương nho
A. Glucozơ B. Saccarozơ C. Fructozơ D. Tinh bột
Trong câu này các em chỉ cần biết glucozơ có nhiều trong quả nho chín nên gọi là đường nho. Phần này các em tập làm ở nhà 4 phút cho 12 câu
2. Mức độ (2): Với các câu lí thuyết yêu cầu HS phải hiểu có thể làm được hoặc các bài tính đơn giản
Ví dụ: Trong thực tế, không sử dụng cách nào sau đây để bảo vệ kim loại sắt khỏi bị ăn mòn ?
A. Gắn đồng với kim loại sắt
B. Tráng kẽm lên bề mặt sắt
C. Phủ một lớp sơn lên bề mặt sắt
D. Tráng thiếc lên bề mặt sắt
Trong ví dụ này các em phải hiểu được cơ chế ăn mòn kim loại thì mới có thể làm được
Các bài tập trong mức độ (2) HS chỉ cần viết được PTHH và dựa vào PTHH tính toán để ra đáp số. Tuy nhiên, các em nên áp dụng các định luật bảo toàn để tiết kiệm thời gian. Trong đề thi THPT quốc gia năm 2017 có 12 câu mức độ (2) các em làm trong khoảng 8 phút
Các câu mức độ (1) và mức độ (2) không khó những các thí sinh không được chủ quan, vì mỗi câu đều có số điểm bằng nhau và không phân biệt mức độ. Có một số HS không làm sai các câu ở mức độ (3) và (4) mà lại sai các câu ở mức độ (1) và (2). Đối với các em muốn đạt điểm cao hơn thì phải làm các câu mức độ cao hơn
3. Mức độ (3): Gồm các câu lí thuyết ở mức độ khó ( thông thường là câu đếm) và các dạng bài tập phức tạp. Ở mức độ này, các em phải nắm chắc kiến thức mới làm đúng được dạng các câu lí thuyết. Đối với các bài tập tính toán, các em vận dụng các phương pháp giải nhanh để bắt kịp thời gian. Có 12 câu mức độ (3), các em luyện tập làm bài trong khoảng 24 phút
Ví dụ: Dung dịch X gồm 0,02 mol Cu(NO3)2 và 0,1 mol H2SO4. Khối lượng Fe tối đa phản ứng được với dung dịch X là (biết NO là sản phẩm khử duy nhất của NO3-)
A. 4,48g B. 5,6g C. 3,36g D. 2,24g
Hướng dẫn giải
nNO3- = 0,04 mol
nH+ = 0,2 mol
nH+ > 4 nNO3-. Vậy sau khi phản ứng muối nitrat phản ứng hết. Dung dịch sau phản ứng hết. Dung dịch sau phản ứng chỉ còn FeSO4 nên số mol Fe bằng số mol gốc sunfat bằng 0,1 mol. Chọn đáp án B
4. Mức độ (4): Thường là các câu dài và rất khó, xếp cuối cùng của bài thi, HS cần lựa chọn đúng phưng pháp để giải một cách nhanh nhất. Thông thường chúng ta sử dụng thành thạo các định luật bảo toàn và vận dụng linh hoạt chúng. Trong đề thì có 4 câu mức độ (4) các em làm trong khoảng 14 phút.
Ví dụ: Cho m gam hỗn hợp X gồm Fe, Fe3O4, Fe(NO3)2 tan hết trong 320ml dung dịch KHSO4 1M. Sau phản ứng thu được dung dịch Y chỉ chứa 59,04g muối trung hòa và 896ml NO( sản phẩm khử duy nhất ở đktc) Y phản ứng vừa đủ với 0,44mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây
A. 63 B. 18 C. 73 D. 20
Hướng dẫn giải: Sau khi cho NaOH vào thì dung dịch sau phản ứng có:
K+ : 0,32 mol; Na+: 0,44 mol; SO42-: 0,32 mol và NO3- dư : x mol
Áp dụng bảo toàn điện tích : x =0,12 mol
Áp dụng bảo toàn nguyên tố N: nFe(NO3)2 = (0,12 + 0,04 ) : 2 = 0,08 mol
Áp dụng bảo toàn nguyên tố với H: nH2O = 0,32 : 2 = 0,16 mol
Áp dụng định luật bảo toàn khối lượng
M = 59,04 + 0,04 .30 + 0,16 .18 – 0,32 .136 = 19,6(g)
%mFe(NO3)2 = 0,08.180/19,6 = 73,46%. Chọn C
Đề luyện thi môn Hóa học THPT Quốc gia năm 2024 có đáp án (Đề 1)
Câu 1: Thứ tự bị khử ở catot khi điện phân dung dịch chứa các ion Cu2+, Fe3+, Ag+, Au3+ lần lượt là
A. Au3+, Ag+, Cu2+, Fe3+
B. Fe3+, Cu2+, Ag+, Au3+
C. Au3+, Ag+, Fe3+, Cu2+
D. Au3+, Fe3+, Ag+, Cu2+
Câu 2: Nhôm là kim loại phổ biến nhất trên vỏ Trái Đất, Trong bảng tuần hoàn các nguyên tố hóa học nhôm thuộc chu kì 3, nhóm IIIA. Cấu hình electron lớp ngoài cùng của nguyên tử nhôm là
A. 3s2
B. 3s23p1
C. 3s1
D. 3s23p3
Câu 3: Hòa tan hoàn toàn 4,6g Na vào nước dư thu được dung dịch X và V lít khi H2. Giá trị V là
A. 2,24 B. 1,12 C. 4,48 D. 3,36
Câu 4: Trong các phát biểu sau, phát biểu nào đúng
A. Cr không tác dụng với nước
B. CrO có tính lưỡng tính
C. Axit H2CrO4 là chất rắn, màu vàng
D. CrO3 không tan trong nước
Câu 5: Cho dung dịch NaOH dư vào dung dịch FeSO4, lọc kết tủa và đem nung trong không khí đến khối lượng không đổi thu được chất rắn là
A. Fe(OH)3
B. FeO
C. Fe(OH)2
D. Fe2O3
Câu 6: Hòa tan 7,2g hỗn hợp muối magie sunfat và một muối sunfat của kim loại kiềm vào nước dư, thu được dung dịch X. Cho dung dịch BaCl2 phản ứng vừa đủ với X, thu được 11,65g kết tủa và dung dịch Y chứa m gam muối. Giá trị m là
A. 6,5 B. 7 C. 8,2 D. 5,95
Câu 7: Một bạn học sinh đã viết các phương trình hóa học sau
(1) 2Fe(NO3)3 + Cu → Cu(NO3)2 +2Fe(NO3)2
(2) Zn + Fe(NO3)2 → Zn(NO3)2 + Fe
(3) 2Ag + 2HCl → 2AgCl + H2
(4) Pb + O2 → PbO2
Nhận định nào sau đây đúng
A. Tất cả các phương trình trên đều đúng
B. Phương trình (1), (2) đúng; (3) và (4) là sai
C. Tất cả phương trình trên đều sai
D. Phương trình (2) và (3) đúng; (1) và (4) là sai
Câu 8: Khí thải công nghiệp và của các động cơ ô tô, xe máy,… là nguyên nhân chủ yếu qây ra mưa axit. Thành phần hóa học chủ yếu trong các khí thải trực tiếp gây ra mưa axit là
A. SO2, CO, NO
B. SO2, CO, NO2
C. NO, NO2, SO2
D. NO2, CO2, CO
Câu 9: Trong các cacbohiđrat sau, chất nào không bị thủy phân
A. Saccarozơ B. Glucozơ C. Tinh bột D. Xenlulozơ
Câu 10: Mùi tanh của cá là do hỗn hợp một số amin gây nên. Vì thế để khử mùi tanh cá người ta dùng
A. Nước vôi B. Phèn chua C. Giấm D. Axit clohiđric
Câu 11: Khi cho 3,75g axit aminoaxetic tác dụng hết với dung dịch NaOH, khối lượng muối tạo thành
A. 9,7 B. 4,85 C. 10 D. 4,5
Câu 12: Để chuyển hoàn toàn 13,26g triolein thành trítearin cần a mol H2. Giá trị của a là
A. 0,015 B. 0,03 C. 0,045 D. 0,06
Câu 13: Cho H2 dư đi qua hỗn hợp A gồm CuO; NiO và Fe2O3 nung nóng đến phản ứng hoàn toàn thu được chất rắn B gồm
A. Cu; Ni; Fe
B. Cu; NiO; Fe
C. Cu; Ni; FeO
D. Cu; NiO; Fe2O3
Câu 14: Tiến hành bốn thí nghiệm sau:
Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3
Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4
Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3
Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl
Số trường hợp xuất hiện ăn mòn điện hóa là
A. 3 B. 4 C. 1 D. 2
Câu 15: Trong công nghiệp Al được điều chế bằng cách
A. Cho Al2O3 phản ứng với CO ở nhiệt độ cao
B. Điện phân AlCl3 nóng chảy
C. Điện phân Al2O3 nóng chảy
D. Cho Mg phản ứng với dung dịch AlCl3
Câu 16: Chất X tác dụng với HNO3 thấy có khí thoát ra. Cho X vào dung dịch HCl dư thu được dung dịch Y. Cho Cu vào dung dịch Y thấy Cu tan ra. Vậy X là chất nào sau đây
A. Fe3O4 B. FeO C. Fe D. Fe2O3
Câu 17: Cho dãy các chất: NH4Cl; (NH4)3PO4; KNO3; Na2CO3 và Ca(H2PO4)2 . Số chất trong dãy khi phản ứng với dung dịch Ca(OH)2 dư tạo nên kết tủa là
A. 2 B. 1 C. 3 D. 4
Câu 18: Cho 2,4g Al, Zn, Fe tác dụng hết với oxi thu được hỗn hợp X gồm 5 oxit có khối lượng là 3,4g. Để hòa tan hết hỗn hợp X cần thể tích dung dịch HCl 1M là
A. 125 ml B. 50ml C. 100ml D. 25ml
Câu 19: Xenlulozơ trinitrat được điều chế từ axit nitric và xenlulozơ. Để có 14,85 kilogam xelulozơ trinitrat cần dung dịch chứa m kilogam axit nitric. Giá trị m là
A. 11,5 B. 8,51 C. 9,45 D. 10,5
Câu 20: Cho 10,2g phenyl axetat tác dụng với 120ml dung dịch NaOH 1,5M đun nóng. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị m là
A. 19,05 B. 14,85 C. 17,82 D. 16,05
Câu 21: Cho các loại tơ: tơ tằm, tơ visco, tơ nilon 6,6, tơ axetat, tơ capron, tơ enang. Các loại tơ nhân tạo là
A. Tơ nilon 6,6 và tơ capron
B. Tơ tằm và tơ enang
C. Tơ visco và tơ nilon 6,6
D. Tơ visco và tơ axetat
Câu 22: Cho 2,6g hỗn hợp X gồm 2 amino no đơn chức, bậc một kế tiếp nhau trong dãy đồng đẳng phản ứng hết với dung dịch HCl dư thu được 4,425 g hỗn hợp muối. Công thức của 2 amin trong X là
A. C2H5NH2 và C3H7NH2
B. C2H3NH2 và C3H5NH2
C. CH3NH2 và C2H5NH2
D. C2H5NH2 và (CH3)2NH
Câu 23: Các chất hữu cơ X, Y, X có cùng công thức phân tử C4H8O2 thỏa mãn các tính chất sau:
- X có cấu tạo mạch cacbon phân nhánh, phản ứng được với Na và NaOH
- Y tác dụng được dung dịch NaOH và được điều chế từ ancol và axit có cùng số nguyên tử cacbon trong phân tử
- Z có cấu tạo mạch cacbon không phân nhánh, tác dụng được với dung dịch NaOH và có phản ứng tráng bạc là
X,Y,Z lần lượt là
A. CH3CH(CH3)COOH, CH3COOCH2CH3, HCOOCH2CH2CH3
B. CH3(CH2)2COOH, CH3COOCH2CH3, HCOOCH2CH2CH3
C. CH3CH(CH3)COOH, CH3CH2COOCH3, HCOOCH2CH2CH3
D. CH3(CH2)2COOH, CH3CH2COOCH3, HCOOCH(CH3)2
Câu 24: Nhận xét nào sau đây đúng
A. Phenyl fomat phản ứng với dung dịch NaOH dư tạo hỗn hợp hai muối
B. Anilin tan trong dung dịch NaOH
C. Metylamin không phản ứng với dung dịch FeCl3
D. Isopropylamin là amin bậc hai
Câu 25: Cho 36g FeO tác dụng phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị a là
A. 1,25 B. 0,5 C. 1,0 D. 0,75
Câu 26: Cho một số đặc điểm sau đây nói về nước cứng tạm thời và nước cứng vĩnh cửu
(1) Tạo kết tủa khi tác dụng với NaOH
(2) Làm hao tốn xà phòng khi giặt rửa
(3) Tạo kết tủa khi tác dụng với Na3PO4
(4) Có chứa các cation Mg2+, Ca2+
Những đặc điểm chung của nước cứng tạm thời và vĩnh cửu là
A. 1,2,3
B. 1,2,4
C. 2,3,4
D. 1,2,3,4
Câu 27: Cho 5,8g muối FeCO3 tác dụng với dung dịch HNO3 vừa đủ, thu được hỗn hợp khí X gồm CO2 và NO và dung dịch Y. Thêm dung dịch HCl dư vào Y sau đó cho tiếp bột Cu vào thì thấy có m gam Cu bị hòa tan và thu được một khí không màu hóa nâu trong không khí. Giá trị của m là
A. 14,4 B. 16 C. 9,6 D. 11,2
Câu 28: Nung nóng 3,5 g hỗn hợp X gồm Al, Mg và Fe trong khí oxi sau một thời gian thu được 4,7g hỗn hợp Y. Hòa tan Y vào dung dịch HNO3 (dư) thu được 1,12l khí NO. Số mol HNO3 đã phản ứng là
A. 0,4 B. 0,3 C. 0,45 D. 0,35
Câu 29: Trên 2 đĩa cân ở vị trí cân bằng có 2 cố thủy tinh. Mỗi cốc đựng 100g dung dịch HCl 16,425%. Thêm vào cốc thứ nhất 20g bột CaCO3. Cần phải thêm ào cốc thứ hai x gam bột MgCO3 để khi phản ứng hóa học kết thúc thì hai đĩa cân vẫn vị trí cân bằng. Giá trị của x gần nhất với
A. 22,53 B. 22,75 C. 21,15 D. 24,45
Câu 30: Cho dãy các chất: Na2SO3, Cr(OH)3, FeO, BaSO4, BaCl2, CuS, NaHCO3. Số chất trong dãy tác dụng với dung dịch H2SO4 loãng là
A. 6 B. 4 C. 3 D. 5
Câu 31: Hợp chất X chứa vòng benzen và có tỉ lệ khối lượng mC : mH : mO = 14:1:8. Đun nóng 2,76g X với 75ml dung dịch KOH 1M (dư 25% so với lượng cần phản ứng) đến khi phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn Y thu được a gam chất rắn khan. Biết X có công thức phân tử trùng với công thức đơn giản nhát. Giá trị a là
A. 5,4 B. 6,6 C. 6,24 D. 6,96
Câu 32: Đốt cháy hoàn toàn 12,36g amino axit X có công thức dạng H2NCxHy(COOH)n thu được a mol H2O và b mol CO2 (a >b) . Cho 0,2 mol X vào 1 lit dung dịch hỗn hợp KOH 4M và NaOH 0,3 M thu được dung dịch Y. Cho tiếp dung dịch HCl dư vào Y đến phản ứng hoàn toàn, thu được dung dịch chứa 75,25g muối. Giá trị a là
A. 0,54 B. 0,3 C. 0,64 D. 0,43
Câu 33: Hỗn hợp X gồm hai hợp chất hữu cơ đơn chức. Cho m gam X tác dụng với 240ml dung dịch NaOH 1M (dư 20% so với lượng cần phản ứng). tạo thành dung dịch Y. Chưng cất Y thu được 20,4g chất rắn khan và một ancol. Đốt cháy hoàn toàn lượng ancol trên thu được 2,24l CO2 và 3,6g H2O. Giá trị m là
A. 15,8 B. 17,2 C. 19,2 D. 18,6
Câu 34: Cho 41,2g hỗn hợp hai chất hữu cơ có công thức phân tử lần lượt là C3H12O3N2 và CH7O3NS tác dụng với 400ml dung dịch KOH 2M đun nóng, sau phản ứng xảy ra hoàn toàn thu được 11,2l môt chất khí duy nhất có khả năng làm xanh quỳ ẩm và dung dịch X. Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị m là
A. 57,9 B. 35 C. 50,6 D. 51,8
Câu 35: Tiến hành các thí nghiệm với các dung dịch X, Y, Z, T thu được kết quả sau
Dung dịch X tạo hợp chất màu xanh đen với dung dịch I2
Dung dịch Y cho phản ứng màu biure với Cu(OH)2
Dung dịch Z tham gia phản ứng tráng bạc
Dung dịch T tạo kết tủa trắng với nước brom
Dung dịch X, Y, Z, T lần lượt là dung dịch
A. Tinh bột, lòng trắng trứng, anilin, glucozơ
B. Tinh bột, anilin, lòng trắng trúng, glucozơ
C. Lòng trắng trứng, tinh bột, glucozơ, anilin
D. Tinh bột, lòng trắng trứng, glucozơ, anilin
Câu 36: Thực hiện các phản ứng sau
X + NaOH → X1 +X2
X2 → X4 + H2O
X1+ NaOH → X3 + Na2CO3
X2+ O2 → X5 + H2O
2X3 → X6 + 3H2
X6 + H20 → X7
X7 + H2 → X2
Nhận xét nào sau đây không đúng
A. X là etyl axetat
B. X6 có phản ứng với AgNO3 /NH3 tạo kết tủa
C. X4 làm mất màu dung dịch KMnO4
D. X5 có phản ứng tráng bạc
Câu 37: Chia 13,6g hỗn hợp X (gồm FeO, Fe2O3, Fe3O4) thành hai phần bằng nhau. Phần (1) hòa tan hoàn toàn dung dịch HNO3 thu được dung dịch X. Cô cạn dung dịch X được 21,78g muối khan. Phần (2) cho tác dụng vừa đủ với 100ml dung dịch chứa HCl a mol/l và H2SO4 b mol/l. Sau phản ứng thu được 14,35g muối khan. Tỉ lệ a:b là
A. 5:7 B. 4:3 C. 5:3 D. 2:3
Câu 38: Hòa tan hết m gan hỗn hợp gồm CuS, FeS và FeS2 bằng dung dịch HNO3 vừa đủ. Sau khi các phản ứng xảy ra hoàn toàn thu được V lít khí NO(sản phẩm khử duy nhất) và dung dịch Y chỉ chứa muối của Cu2+; Fe3+ với một anion. Cho Y tác dụng với dung dịch BaCl2 dư thu được 34,95g kết tủa. Mặt khắc, nếu cho Y tác dụng với dung dịch Ba(OH)2 dư thì thu được 46,45g kết tủa. Số mol HNO3 đã phản ứng là
A. 1,6 B. 0,4V C. 1,2 D. 1
Câu 39: Đốt cháy hoàn toàn 1,7g hỗn hợp chất hữu cơ X (MX > 140) cần vừa đủ 2,52 lít O2(dktc) sản phẩm cháy thu được gồm CO2 và H2O với tỉ lệ mol tương ứng là 2:1. Biết rằng 1 mol X phản ứng tối đa hết 200g dung dịch NaOH 40%. X không tham gia phản ứng tráng bạc. Số đồng phân cấu tạo của X là
A. 5 B. 6 C. 7 D. 8
Câu 40: X là tripeptit; Y là pentapeptit đều mạch hở. Hỗn hợp T gồm X và Y có tỉ lệ tương ứng là 2 :3. Thủy phân hoàn toàn 149,7g T trong môi trường axit thu được 178,5g hỗn hợp các amino axit. Cho 149,7g T vào dung dịch chứa 1 mol KOH và 0,5 mol NaOH, đun nóng hỗn hợp để phản ứng thủy phân xảy ra hoàn toàn thu được dung dịch A. Tổng khối lượng chất rắn trong A là
A. 185,2g B. 199,8g C. 212,3g D. 256,7g
Đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | C | A | A | D | C | B | D | D | B |
| Câu | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Đáp án | D | D | B | C | B | A | B | D | C | A |
| Câu | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Đáp án | B | B | A | D | B | C | B | A | A | D |
| Câu | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Đáp án | D | B | B | C | C | A | D | C | A | D |
Hướng dẫn giải
Câu 34:
Tác dụng với KOH mà thu được 1 khí duy nhất hóa xanh quỳ tím ẩm thì
Với công thức phân tử C3H12O3N2 suy ra công thức cấu tạo là (CH3NH3)2CO3
Với công thức phân tử CH7O3NS suy ra công thức cấu tạo là CH3NH3HSO3
(CH3NH3)2CO3 + KOH → K2CO3 + 2CH3NH2 + 2H2O
CH3NH3HSO3 + 2KOH → K2SO3 + CH3NH2 + 2H2O
Ta có 41,2 /113 = 0,365 > nhỗn hợp > 41,2/124 = 0,332
=> nKOH p/ư = 2nhỗn hợp < nKOH ban đầu =0,8 mol => KOH dư
2x + y = 0,5
124x + 113y = 41,2
=>x= 0,15; y = 0,2
M = 138.0,15 + 158.0,2 + 0,1 .56 = 57,9g
Câu 37:
Xét phần (1) Muối khan khi cô cạn X là Fe(NO3)3 => nFe(NO3)3 = 0,09 mol
Bảo toàn nguyên tố Fe => nFe(X) = 0,18 mol => nO(X) = 0,22 mol
Xép phần (2) Áp dụng BTKL
=> 35,5nCl- + 96nSO42- = 14,35 – 0,09 . 56 = 9,31
Áp dụng DLBT điện tích
nCl- + 2nSO42- = nH+ =2nO = 2.1/2.nO(X) = 0,22 mol (2)
(1) và (2) => nCl- = 0,1 mol; nSO42- = 0,06 mol
a/b = 0,1 /0,06 =5:3
Câu 38:
Quy đổi hỗn hợp thành Cu, Fe, S
nCu =a mol; nFe = b mol; nS = c mol
Dung dịch Y gồm Fe3+ (b mol); Cu2+ (a mol); SO42- (c mol)
Bảo toàn điện tích 3b + 2a = 2c
Y + BaCl2 → BaSO4 (c mol)
=> C = 34,95/233 = 0,15 mol
Y + Ba(OH)2 → BaSO4 (0,15 mol) ; Cu(OH)2 (a mol); Fe(OH)3 (b mol)
=> 107b + 98a = 46,45 -34,95 = 11,5 (2)
(1), (2) => a= 0,03 ; b =0,08
ne = 2a + 3b + 6c =1,2 mol
nHNO3 p/ư = nNO = 0,4 mol (do NO3- hết)
Câu 39:
nO2 = 0,1125 mol; nNaOH = 2 mol
Vì X + O2 → CO2 + H2O => X có thể chứa C, H, O
DLBTKL: mCO2 + mH2O = mX + mO2 = 1,7 + 0,1125 .32 = 5,3g
Đặt a,b là số mol CO2, H2O => 44a + 18b = 5,3 (1)
Theo bài ra ta có a =2b (2)
Giải hệ (1), (2) ta có a = 0,1l, b =0,05
mC = 0,1 . 12 = 1,2 g
mH = 0,05 . 2 = 0,1 g
mO = mX – (mC + mH) = 0,4g
X là CXHyOz : x : y :z = 4 : 4 :1
CTTN của X : (C4H4O)n do MX < 140 nên 68n < 140 => n =1 hoặc n =2
Vì 1 mol X tác dụng tối đa với 2 mol NaOH, X không tham gia phản ứng tráng bạc nên X phải có 2 nhóm –OH gắn với vòng benzen hoặc X là este đơn chức của axit cacboxylic đơn chức với phenol
Từ đó suy ra phải có 2 nguyên tử O trong phân tử và CTPT của X là C8H8O2
Số đồng phân cấu tạo của X là 7
Câu 40:
X(tri): 2a
Y(penta) : 3a
H2O :(178,5-149,7)/18 = 1,6 mol
2a.2 + 3a.4 =1,6 => a =0,1 => nCOOH = 2a.3 + 3a.5 = 21a =2,1 =nOH-
Áp dụng BTKL 178,5 + 1.56 + 1,5.40 = m + 2,1.18 => m =256,7g
Đề luyện thi môn Hóa học THPT Quốc gia năm 2024 có đáp án (Đề 2)
Câu 1: Phản ứng hóa học nào sau đây không tạo khí H2?
A. Fe + HCl →
B. Mg + H2SO4 loãng →
C. Zn + HBr →
D. Cu + HNO3 →
Câu 2: Kim loại nào sau đây thuộc nhóm kim loại kiềm ?
A. Na B. Ba C. Al D. Fe
Câu 3: Hợp chất của kim loại kiềm thổ phổ biến và có nhiều ứng dụng nhất là hợp chất của kim loại
A. Ba B. Ca C. Mg D. Be
Câu 4: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch ?
A. CuSO4
B. FeCl2
C. FeCl3
D. AgNO3
Câu 5: : Khối lượng bột nhôm để điều chế 78 gam crom từ Cr2O3 bằng phương pháp nhiệt nhom (hiệu suất của phản ứng là 90%) là
A. 81,0 gam B. 54,0gam C. 40,5gam D. 45,0gam
Câu 6: Dung dịch X tác dụng với dung dịch H2SO4 loãng chỉ thu được dung dịch Y và khí Z thoát ra. Chất X là
A. BaCO3
B. NaCl
C. Ba(HCO3)2
D. Na2CO3
Câu 7: Cho một ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm
A. Fe(NO3)2, H2O
B. Fe(NO3)2, AgNO3 dư
C. Fe(NO3)3, AgNO3 dư
D. Fe(NO3)2, Fe(NO3)3,AgNO3 dư
Câu 8: Không khí sẽ bị ô nhiễm khi tăng cao nồng độ của chất nào sau đây ?
A. Khí N2
B. Khí O2
C. Khí CO2
D. Hơi nước
Câu 9: Công thức phân tử của etyl format là
A. C2H4O2
B. C4H8O2
C. C3H8O2
D. C3H6O2
Câu 10: Hãy cho biết hiện tượng nào sau đây được mô tả không đúng ?
A. Cho dung dịch HCl vào anilin, ban đầy có hiện tượng tách lớp sau đó đồng nhất
B. Cho dung dịch NaOH vào dung dịch metyl amoni clorua thấy có kết tủa trắng
C. Nhúng quỳ tím vào dung tịch etylamin, thấy quỳ tím chuyển màu xanh
D. Phản ứng giữa khí metylamin và khí hidro clorua làm xuất hiện “khói trắng”
Câu 11: Cho các chất: (1)CH3 NH2, (2) NH3,(3) H2NCH2COOH, (4) (CH3)2NH. Dãy các chất được sắp xếp theo chiều giảm dần tính bazơ là
A. (1),(2),(3),(4)
B. (4),(1),(3),(2)
C. (1),(4),(3),(2)
D. (4),(1),(2),(3)
Câu 12: Cho dãy các chất sau : vinyl format, metyl acrylat, glucozơ, saccarozư, etylamin, alanin. Phát biểu nào sau đây sai ?
A. Có 3 chất bị thủy phân trong môi trường kiềm
B. Có 3 chất làm mất màu nước Brom
C. Có 3 chất hữu cơ đơn chứ, mạch hở
D. Có 2 chất tham gia phản ứng tráng bạc
Câu 13: Hai lá kim loại Sn và Fe tiếp xúc nhau được nhúng vào cùng một dung dịch HCl. Phát biểu nào sau đây là đúng?
A. Fe bị ăn mòn điện hóa học
B. Cả Sn và Fe đều không bị ăn mòn điện hóa học
C. Sn bị ăn mòn điện háo học
D. Cả Sn và Fe đều bị ăn mòn điện hóa học
Câu 14: Cho 9,2 gam hỗn hợp bột X gồm Mg và Fe là 1 lít dung dịch CuSO4 0,2 M.Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và 15,6 gam chất rắn. Phần trăm khối lượng của Mg trong X là
A. 39,13 % B. 73,91% C. 60,91% D. 26,09%
Câu 15: Thêm từ từ 100 ml dung dịch HCl 0,5M vào 200 ml dung dịch Na2CO3 0,2M, thu được dung dịch X và V lít khí CO2 (đktc). Giá trị của V là
A. 0,224 B. 0,56 C. 1,12 D. 0,896
Câu 16: Cho 1 mol chất X tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) tạo 0,5 mol SO2 (sản phẩm khử duy nhất). Chất X nào sau đây phù hợp?
A. FeI2
B. FeS
C. FeSO3
D. FeCO3
Câu 17: Tiến hành các thí nghiệm sau :
(a) Nhúng thanh sắt vào dung dịch Fe2(SO4)3
(b) Nhúng thanh sắt vào dung dịch MgCl2
(c) Sục khí CO2 vào dụng dịch NaAlO2
(d) Cho dung dịch Na2S vào dung dịch FeCl2
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng hóa học là
A. 1 B. 4 C. 2 D. 3
Câu 18: Hòa tan hoàn toàn hỗn hợp gồm 1,92 gam Cu và 0,84 gam Fe bằng dung dịch HNO3 dư, thu được hoàn toàn 1,008 lít khí NO2 và x lít khí NO (các khí ở đktc, không còn sản phẩm khử nào khác của N+5). Giá trị của x là
A. 0,336 B. 0,448 C. 1,12 D. 0,672
Câu 19: Số đồng phân este no, đơn chức, mạch hở ứng với công thức phân tử C5H10O2 là
A. 9 B. 6 C. 7 D. 8
Câu 20: Một kim loại gạo có chứa 81 % tinh bột được dùng để nấu rượu với hiệu suất 80 %. Khối lượng gạo cần dùng để nấu được 300 lít rượu 46o (biết khối lượng riêng của C2H5OH nguyên chất là 0,8 g/ml) là
A. 240 kg B. 300kg C. 270kg D. 243kg
Câu 21: Thủy phân hết một lượng tripeptit Ala-Gly-Ala (mạch hở), thu được hỗn hợp gồm 97,9 gam Ala; 22,5 gam Gly; 29,2 gam Ala-Gly và m gam Gly-Ala. Giá trị của m là
A. 49,2 B. 43,8 C. 39,6 D. 48,0
Câu 22: Nilon-6,6 là sản phẩm trùng ngưng của chất nào sau đây ?
A. axit ađipic và hexametylenđiamin
B. axit ε-aminocaproic
C. axit 4-aminobutanoic
D. phenol và fomandehit
Câu 23: Phát biểu nào sau đây là sai ?
A. HCOOCH=CH2 phản ứng với dung dịch NaOH thu được andehit và muối
B. CH3COOH=CH2 thuộc cùng dãy đồng đẳng với CH2=CHCOOCH3
C. HCOOCH=CH2 có phản ứng trùng hợp
D. CH3COOH=CH2 làm mất màu dung dịch Br2
Câu 24: Triolein (hay glixeryltrioleat) không tác dụng với chất nào sau đây?
A. H2 (xt Ni, to)
B. NaOH, to
C. Cu(OH)2 ở to thường
D. Br2 trong CCl4
Câu 25: Mắc nối tiếp hai bình điện phân, bình (I) đựng 500 ml dung dịch Cu(NO3 )2 0,1 M, bình (II) đựng 1 lít dung dịch NaCl. Sau một thời gian điện phân (điện cực trơ, màng ngăn xốp) pH của bình (II) bằng 12. Lượng Cu thu được ở catot bình (I) là
A. 1,6 gam B. 0,16gam C. 0,32gam D. 3,2gam
Câu 26: Cho 240 ml dung dịch KOH 1,5 M vào V lít dung dịch AlCl3 aM thu được 7,8 gam kết tủa. Nếu cho 100ml dung dịch KOH 1,5M vào V lít dung dịch AlCl3 aM thì số gam kết tủa thu được là
A. 5,85 B. 3,9 C. 2,6 D. 7,8
Câu 27: Cho m gam bột sắt vào 200 ml dung dịch HNO 3 4M, đung nóng, sau khi các phản ứng xảy ra hoàn toàn thu được khí NO (sản phẩm khử duy nhất) và dung dịch chỉ chứa 52,6 gam muối. Giá trị của m là
A. 11,20 B. 12,17 C. 16,8 D. 15,4
Câu 28: X, Y, Z, T tác dụng với H 2SO 4 đều tạo FeSO 4 và Fe(NO 3 ) 2 → X → Y → Z → T (mỗi mũi tên ứng với một phản ứng). X, Y, Z, T lần lượt là
A. FeCO 3, FeO, Fe, FeS
B. FeS, Fe(OH) 2 , FeO, Fe
C. FeCl 2 , Fe(OH) 2 , FeO, Fe
D. FeS, Fe 2 O 3 , Fe, FeCl 2
Câu 29: Có các nhận xét sau :
(1) Hàm lượng cacbon trong gang lớn hơn trong thép
(2) Cho gang (hợp kim của Fe và C) vào dung dịch HCl xuất hiện sự ăn mòn điện hóa
(3) Trong môi trường kiềm Cr +3 bị Cl 2 oxi hóa đến Cr +6
(4) Kim loại Cu được tạo ra khi cho CuO phản ứng với khí NH 3 hoặc H 2 ở nhiệt dộ cao.
Trong các nhận xét trên, số nhận xét đúng là
A. 2 B. 3 C. 1 D. 4
Câu 30: Hỗn hợp rắn X gồm Al, Fe 2 O 3 và Cu có số mol bằng nhau. Hỗn hợp X tan hoàn toàn trong dung dịch
A. AgNO 3 (dư)
B. NaOH (dư)
C. NH 3 (dư)
D. HCl (dư)
Câu 31: Hợp chất hữu cơ X có công thức phân tử C 5 H 6 O 4 . X tác dụng với NaOh trong dung dịch theo tỉ lệ mol 1:2, tạo ra muối của axit no Y và ancol Z. Dẫn Z qua CuO nung nóng thu được andehit T có phản ứng tráng bạc, tạo ra Ag theo tỉ lệ mol 1:4. Biết Y không có đồng phân nào khác. Phát biểu nào sau đây là đúng?
A. Ancol Z không no có 1 liên kết C=C.
B. Axit Y có tham gia phản ứng tráng bạc
C. Ancol Z không hòa tan Cu(OH) 2 để tạo dung dịch màu xanh.
D. Anđehit T là chất đầu tiên trong dãy đồng đẳng
Câu 32: Amin X chứa vòng benzen và có công thức phân tử C 8 H 11 N. X tác dụng với HCl tạo thành muối dạng R-NH 3 Cl. Mặt khác, nếu cho X tác dụng với nước brom thì thu được chất Y có công thức C 8 H 10 NBr 3 . Số công thức cấu tạo của X là
A. 2 B. 3 C. 5 D. 6
Câu 33: Cho các polime sau : thủy tinh hữu cơ (plexiglas), tơ nilon-6, tơ nitron, tơ capron, cao su buna-S, poliisopren, poli(etylen terephtalat). Số polime điều chế bằng phương pháp trùng hợp là :
A. 4 B. 5 C. 2 D. 3
Câu 34: Chất hữu cơ X có công thức C3H9O2N. Cho X phản ứng với dung dịch NaOH đun nóng, thu được muối Y, khí Z làm xanh giấy quỳ tím ẩm. Nung Y với NaOH rắn và CaO, thu được khí metan. Công thức của X là
A. C 2 H 5 COO-NH 4
B. HCOO-NH 2 (CH 3 ) 2
C. CH 3 COO-H 3 NCH 3
D. HCOO-NH 3 C 2 H 5
Câu 35: Cho các chất : xenlulozo, phenylamoni clorua, axit glutamic, saccarozo, phenol, metyl aminoaxetat, Ala-Gly, glixerol, natri axetat. Số chất tác dụng với dung dịch NaOH loãng, nóng là
A. 5 B. 4 C. 7 D. 6
Câu 36: Đốt cháy hoàn toàn 10,8 gam hợp chất hữu cơ X thu được 4,48 lít CO 2, 7,2 gam H 2 O và 2,24 lít khí N 2 . Nếu cho 0,1 mol chất X trên tác dụng với dung dịch chứa 0,2 mol NaOH đun nóng thu được chất khí làm xanh giấy quỳ ẩm và dung dịch Y. Cô cạn dung dịch Y thu được số gam chất rắn khan là ( Biết các chất khí đo ở đktc, X có công thức phân tử trùng với công thức đơn giản nhất)
A. 21,8 gam B. 5,7g C. 12,5g D. 15g
Câu 37: Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO 3)2 (điện cực trơ, màng ngăn xốp) sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào X đến khi các phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt giảm 2,6 gam và thoát ra khí NO duy nhất. Giá trị của x là
A. 0,3 B. 0,4 C. 0,2 D. 0,5
Câu 38: Cho 7,56 gam hỗn hợp gồm Al và Mg cùng với 0,25 mol Cu(NO 3 )2 vào một bình kín. Nung bình một thời gian thu được sản phẩm gồm chất rắn X và 0,45 mol hỗn hợp khí NO 2 và O 2 . Hòa tan toàn bộ X trong 650 ml dung dịch HCl 2M vừa đủ, thu được dung dịch Y chứa m gam hỗn hợp muối clorua và thoát ra 1,12 lít hỗn hợp khí Z (ở đktc) gồm N 2 và H 2 , tỉ khối của Z so với H 2 là 11,4. Giá trị của m gần nhất với giá trị nào sau đây?
A. 72 B. 71 C. 70 D. 73
Câu 39: Hỗn hợp X gồm peptit A có công thức Gly-Gly-Val và peptit mạch hở B có công thức CxH yN6O7 . Lấy 0,06 mol X tác dụng vừa đủ với 0,24 mol NaOH chỉ thu được sản phẩm là dung dịch gồm p mol muối của glyxin , q mol muối của valin. Nếu đốt cháy hoàn toàn 9,06 gam hỗn hợp X bằng lượng oxi vừa đủ thì thu được N 2 và 21,78 gam hỗn hợp CO2 và H2O. Giá trị của p : q gần nhất với
A. 0,50 B. 1,96 C. 1,05 D. 2,01
Câu 40: X là trieste của glixerol và 3 axit đơn chức. Đốt cháy a mol X thu được b mol CO 2 và c mol H2O. Hidro hóa m gam X cần 5,6 lít H2 (đktc) thu được 32,75 gam Y. Nếu đun m gam X với dung dịch NaOH vừa đủ thu được m’ gam muối khan. Biết b – c = 4a. Các phản ứng xảy ra hoàn toàn. Giá trị của m’ là
A. 35,75 gam
B. 35,5 gam
C. 30,0 gam
D. 41,0 gam
Đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | A | B | B | D | D | C | C | D | B |
| Câu | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Đáp án | D | A | A | A | A | D | D | B | A | B |
| Câu | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Đáp án | B | A | B | C | C | B | D | A | D | D |
| Câu | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Đáp án | C | C | B | C | A | C | B | C | B | A |
Hướng dẫn giải
Câu 31:
X có độ bất bão hòa Δ = 3. X có 4 nguyên tử O, tác dụng với NaOH theo tỉ lệ mol 1 : 2, tạo ra muối của axit no Y và ancol Z
=> X là este 2 chức ; có 2 liên kết π ở 2 nhóm chức –COO-.
Vậy còn 1 độ bất bão hòa, có 2 khả năng :
Khả năng 1 : Có 1 liên kết C=C ở ancol Z
=> ancol 2 chức => Z có ít nhất 4C
=> X sẽ có ít nhất 6C( loại)
Khả năng 2 : Có 1 mạch vòng => Y và Z đều no, 2 chức.
- Trường hợp 1 : Y là HOOC-CH2-COOH ; Z là C2H4(OH)2.
=> Y còn đồng phân HOOC-COO-CH3 (loại)
- Trường hợp 2 : Y là HOOC-COOH ; Z là C3H6(OH)2 , Z tạo andehit 2 chức
=> Z a=là HO-CH2-CH2-CH2-OH (không hòa tan Cu(OH)2 để tạo dung dịch màu xanh).
Câu 38:
Dùng sơ đồ đường chéo : N2 = 0,04 ; H2 = 0,01
Có H2 thoát ra chứng tỏ NO3- hết.
nAl = x mol , nMg = y mol => 27x + 24y = 7,56 (*)
nNO2 + nNH4+ + 0,04.2 = 2.0,25 (1)
Bảo toàn nguyên tố Cl :
3nAlCl3 + 2nMgCl2 + 2nCuCl2 + nNH4Cl = 3x + 2y + 2.0,25 + n_(NH_4^+ ) = 1,3
3x + 2y = 0,8 - nNH4+
Bảo toàn electron :
3x + 2y + 4nO2 = nNO2 + 10nN2 + 8nNH4+ + 2nH2 = nNO2 + 10.0,04 + 8nNH4+ + 2.0,01
0,8 - nNH4+ + 4nO2 = nNO2 + 8nNH4+ + 0,42 (2)
nNO2 + nO2 = 0,45 (3)
Từ (1), (2) và (3) => nNO2 = 0,4 ; nO2 = 0,05 ; nnNH4+ = 0,02
3x + 2y = 0,78 (**)
Từ (*), (**) => x = 0,2 ; y = 0,09
m = 0,2.133,5 + 95.0,09 + 135.0,25 + 53,5.0.02 = 70,07
Câu 39:
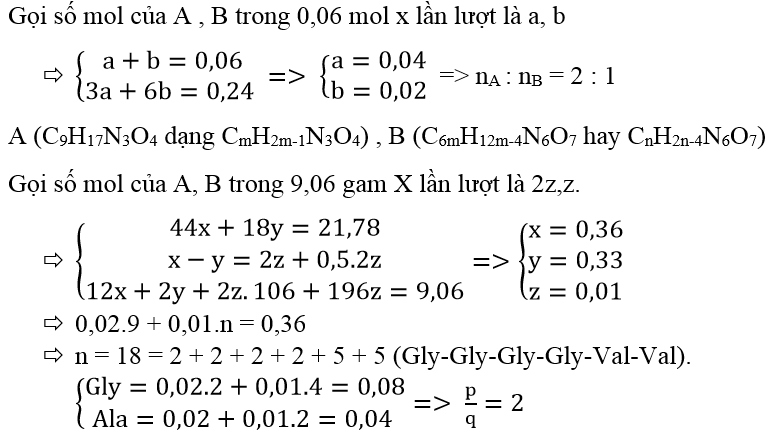
Câu 40:

Tham khảo thêm các Đề thi trắc nghiệm môn Hóa học khác:
- Đề luyện thi môn Hóa học THPT Quốc gia năm 2024 có đáp án - Đề 1
- Đề luyện thi môn Hóa học THPT Quốc gia năm 2024 có đáp án - Đề 2
- Đề luyện thi môn Hóa học THPT Quốc gia năm 2024 có đáp án - Đề 3
- Đề luyện thi môn Hóa học THPT Quốc gia năm 2024 có đáp án - Đề 4
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



