Bài 22.17 trang 52 SBT Hóa học 12
Bài 22: Luyện tập: Tính chất của kim loại
Bài 22.17 trang 52 Sách bài tập Hóa học 12: Chia 100 g dung dịch muối có nồng độ 6,8% làm hai phần bằng nhau.
- Phần một cho tác dụng với dung dịch NaOH dư, tạo ra một bazơ không tan, làm khô chất này thu được một oxit có khối lượng 2,32 g.
- Phần hai cho tác dụng với dung dịch NaCl dư thu được 2,87 g kết tủa không tan trong dung dịch axit.
a) Xác định công thức hoá học của muối có trong dung dịch ban đầu.
b) Trình bày các phương pháp hoá học điểu chế kim loại từ muối tìm được ở trên.
Lời giải:
a) Đặt công thức của muối là AmBn. Khối lượng mol của A, B là X, Y.
Khối lượng muối trong mỗi phần là 3,4 g. Ta có sơ đồ biến đổi các ch trong thí nghiệm 1 :
2AmBn NaOH→ 2mA(OH)n to→ mA2On
Theo sơ đồ : 2(mX + nY) g AmBn tạo thành m(2X + 16n) g A2On.
Theo bài toán : 3,4 g AmBn →2,32 g A2On
Ta có phương trình : 3,4m(2X + 16n) = 2,32.2(mX + nY) (1)
Sơ đồ biến đổi các chất trong thí nghiệm 2 :
AmBn NaCl→ mACln
Theo sơ đồ : (mX + nY) g AmBn tạo thành m(X + 35,5n) g ACln.
Theo bài toán : 3,4 g AmBn →2,87 g ACln
Ta có phương trình : 3,4m(X + 35,5n) = 2,87(mX + nY) (2)
Chia ( 1 ) cho (2) ta được
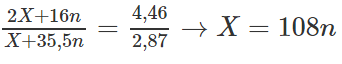
Giá trị có thể chấp nhận là n = 1 và X = 108. Vậy kim loại A là Ag.
Thay n = 1 và X = 108 vào (1) hoặc (2) ta có Y = 62m. Gốc axit trong m bạc không thể là gốc halogenua hoặc sunfua mà là gốc axit có oxi có khối lượng 62, gốc đó là NO3-
Vậy công thức hoá học của muối là AgNO3.
b) Điều chế Ag từ AgNO3 :
Dùng kim loại mạnh hơn Ag để đẩy Ag : Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Nhiệt phân :
AgNO3 to→ Ag + NO2 + 1/2O2
Điện phân với điện cực trơ :
4AgNO3 + 2H2O đpdd→ 4Ag + O2 + 4HNO3
Các bài giải sách bài tập Hóa học 12 (SBT Hóa học 12) khác:
- Bài 22.1, 22.2, 22.3, 22.4, 22.5, 22.6, 22.7, 22.8, 22.9, 22.10, 22.11, 22.12 trang 49 Sách bài tập Hóa học 12: Kim loại Ni phản ứng ....
- Bài 22.13 trang 51 Sách bài tập Hóa học 12: Hãy trình bày phương pháp ....
- Bài 22.14 trang 51 Sách bài tập Hóa học 12: Có sáu dung dịch ....
- Bài 22.15 trang 51 Sách bài tập Hóa học 12: Người ta phủ một ....
- Bài 22.16 trang 51 Sách bài tập Hóa học 12: Pha chế dung dịch ....
- Bài 22.17 trang 52 Sách bài tập Hóa học 12: Chia 100g dung dịch ....
- Bài 22.18 trang 52 Sách bài tập Hóa học 12: Ngâm một lá kim loại ....
- Bài 22.19 trang 52 Sách bài tập Hóa học 12: Trong một bình kín ....
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

