11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học (có lời giải)
Với 11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học.
11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học (có lời giải)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Dạng 1: Đơn chất oxi, lưu huỳnh tác dụng với kim loại
Phương pháp giải
+ Kim loại phản ứng với oxi, kim loại sẽ đạt số oxi hóa cao hoặc thấp
+ Kim loại phản ứng với lưu huỳnh, kim loại sẽ đạt số oxi hóa thấp hơn
2M + xO2 → 2M2Ox
2M + xS → M2Sx
Khi giải bài toán này chúng ta nên sử dụng định luật bảo toàn khối lượng; bảo toàn nguyên tố; bảo toàn electron.
Chú ý: Khi bài toán cho khối lượng cả 2 chất tham gia cần xác định chất dư chất hết để giải toán
Ví dụ minh họa
Ví dụ 1: Oxi hoá hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Giá trị của m là:
A. 7,4 gam B. 8,7 gam
C. 9,1 gam D. 10 gam
Lời giải:
Cách 1: Thông thường.
Gọi a là số mol mỗi kim loại Cu, Al trong hỗn hợp X.
Ta có: moxit = mCuO + mAl2O3
= 80a + 102a/2 = 13,1 ⇒ a = 0,1 mol
mX = 64.0,1 + 27.0,1 = 9,1 gam
⇒ Đáp án C
Cách 2: Dùng bảo toàn nguyên tố và bảo toàn khối lượng.
Cách này không cần viết và cân bằng phương trình phản ứng.
Gọi a là số mol mỗi kim loại Cu, Al trong hỗn hợp X.
Bảo toàn nguyên tố Cu và nguyên tố Al
⇒
Bảo toàn khối lượng ⇒ mY = mCuO + mAl2O3
= 80a + 51a = 13,1 ⇒ a = 0,1 mol
mX = 64.0,1 + 27.0,1 = 9,1 gam
⇒ Đáp án C
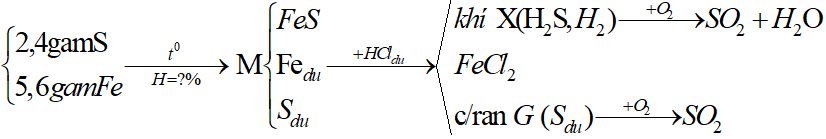
Ví dụ 2: Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là:
A. 2,80. B. 3,36.
C. 3,08. D. 4,48.
Lời giải:
Sơ đồ phản ứng:
Nhìn tổng quát cả bài toán ta có:
Bảo toàn electron:
4nS + 2nFe = 4nO2 ⇒ nO2 = 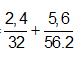
⇒ VO2 = 0,125.22,4 = 2,8 lít
⇒ Đáp án A
Dạng 2: Bài tập về oxi, ozon
Phương pháp giải
+ Đối với bài toán hỗn hợp khí thường sử dụng sơ đồ đường chéo để xác định được số mol, thể tích của các chất.
Chú ý tới các phản ứng:
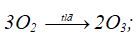
+ Phản ứng ozon hóa:
+ Phản ứng ozon phân:
2O3 → 3O2;
Ví dụ minh họa
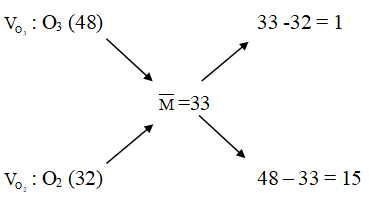
Ví dụ 1: Phóng điện qua O2 được hỗn hợp khí có khối lượng mol trung bình là 33 g/mol. Hiệu suất của phản ứng ozon hóa là
A. 7,09%. B. 9,09%.
C. 11,09%. D. 13,09%.
Lời giải:
Phương trình phản ứng:
Hỗn hợp khí gồm O3 sinh ra và O2 dư
Sơ đồ đường chéo:
⇒ Đáp án B
Ví dụ 2: Một bình cầu dung tích 0,336 lit được nạp đầy oxi rồi cân được m1 gam. Phóng điện để ozon hoá, sau đó nạp thêm cho đầy oxi rồi cân, thu được khối lượng là m2. Khối lượng m1 và m2 chênh lệch nhau 0,04 gam. Biết các thể tích nạp đều ở điều kiện tiêu chuẩn. Thành phần phần trăm về thể tích của ozon trong hỗn hợp sau phản ứng gần nhất với giá trị nào sau đây?
A. 9%. B. 10%.
C. 18%. D. 17%.
Lời giải:
Sơ đồ giải tán:
Sử dụng phương pháp tăng giảm khối lượng:
Cứ 1 mol O3 tạo thành có khối lượng nhiều hơn 1 mol O2 là: 48-32 = 16 gam.
Vậy x mol O3 tạo thành có khối lượng nhiều hơn x mol O2 là 0,04 gam
⇒ nO3 = x = 0,04/16 = 0,0025 mol
⇒ VO3 = 0,0025.22,4 = 0,056 lít
⇒ %VO3 =
⇒ Đáp án D
Dạng 3: Bài tập tính oxi hóa mạnh của ozon
Phương pháp giải
+ Ozon có tính oxi hóa rất mạnh, mạnh hơn oxi, nó oxi hóa nhiều đơn chất và hợp chất.
O3 + 2KI + H2O → O2 + 2KOH + I2.
O3 + 2Ag → Ag2O + O2
Ví dụ minh họa
Ví dụ 1:
A. 50%. B. 25%.
C. 75%. D. 80%.
Lời giải:
Phương trình phản ứng:
O3 + 2KI + H2O → O2 + 2KOH + I2.
Ta có:
⇒
⇒ Đáp án A
Ví dụ 2: Những phản ứng nào sau đây chứng minh tính oxi hóa của ozon mạnh hơn oxi ?
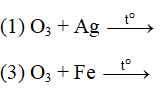
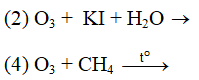
A. 1,2. B. 2,3.
C. 2,4. D. 3,4.
Lời giải:
⇒ Đáp án A
Dạng 4: Bài tập điều chế oxi
Phương pháp giải
+ Nguyên tắc để điều chế oxi trong phòng thí nghiệm là nhiệt phân hợp chất giàu oxi, kém bền nhiệt.
+ Ví dụ:
+ Để giải các dạng bài này có thể viết các phương trình hóa học hoặc sử dụng định luật bảo toàn electron, bảo toàn nguyên tố.
Ví dụ minh họa
Ví dụ 1:
A. 7,84 lit. B. 3,36 lit .
C. 3,92 lit. D. 6,72 lit.
Lời giải:
Phương trình phản ứng:
Để V đạt giá trị lớn nhất thì phản ứng phải xảy ra hoàn toàn, suy ra:
Ta có:
⇒
⇒ Đáp án C
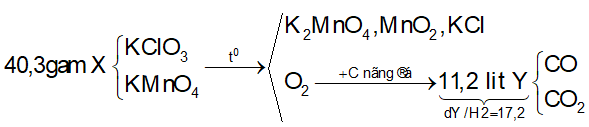
Ví dụ 2: Nhiệt phân 40,3 gam hỗn hợp X gồm KClO3 và KMnO4, thu được O2 và m gam chất rắn gồm K2MnO4, MnO2 và KCl . Toàn bộ lượng O2 tác dụng hết với cacbon nóng đỏ, thu được 11,2 lít hỗn hợp khí Y (đktc) có tỉ khối so với H2 là 17,2. Thành phần % theo khối lượng của KMnO4 trong X gần nhất với giá trị nào sau đây?
A. 40% B. 80%
C. 60% D. 20%
Lời giải:
Sơ đồ phản ứng:
Bảo toàn nguyên tố O:
⇒ Đáp án A
Dạng 5: Bài toán phản ứng tạo kết tủa của muối sunfua và sunfat
Phương pháp giải
+ Một số muối sunfua( như Na2S, K2S, BaS, CaS...) tan trong nước. Hầu hết các muối sunfua không tan trong nước.
- Một số muối sunfua không tan trong nước, nhưng tan trong dung dịch axit như FeS, ZnS, MgS...
- Một số muối sunfua không tan trong nước và cũng không tan trong các dung dịch axit (HCl, H2SO4 loãng, HNO3 loãng...) như CuS, PbS...
+ Hầu hết muối sunfat đều tan trong nước. Một số muối sunfat không tan trong nước và không tan trong axit mạnh (HCl, HNO3...) như BaSO4, SrSO4, PbSO4...
+ Khi giải bài tập chúng ta nên áp dụng định luật bảo toàn nguyên tố, bảo toàn khối lượng ...
Ví dụ minh họa
Ví dụ 1: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Thành phần phần trăm về khối lượng của FeS trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 94%. B. 6%
C. 60% D. 40%
Lời giải:
Sơ đồ bài toán:
Cách 1: Thông thường
Gọi x, y lần lượt là số mol Fe, FeS trong hỗn hợp X.
Phương trình phản ứng:
Ta có:
⇒ Đáp án A
Cách 2: Dùng định luật bảo toàn.
Bảo toàn nguyên tố S
Ta có:
Bảo toàn electron: ⇒ nFe = nH2 = 0,02 mol
⇒ Đáp án A
Ví dụ 2: Thêm từ từ dung dịch BaCl2 vào 300ml dung dịch Na2SO4 1M cho đến khi khối lượng kết tủa bắt đầu không đổi thì dừng lại, thấy hết 500 ml. Nồng độ mol/l của dung dịch BaCl2 là:
A. 0,3M. B. 0,6M.
C. 0,5M. D. 0,15M.
Lời giải:
Phương trình phản ứng: Na2SO4 + BaCl2 → BaSO4↓(trắng) + 2NaCl.
Phản ứng đến khi kết tủa không đổi, tức là Na2SO4 đã hết.
⇒ Đáp án B
Dạng 6: Bài toán H2S, SO2 tác dụng với dung dịch bazơ
Phương pháp giải
+ H2S, SO2 khi tác dụng với dung dịch bazo sẽ tạo ra muối axit, muối trung hòa phụ thuộc vào số mol của chúng với số mol OH-. Ta có thể chia ra các trường hợp như bảng sau:
+ Khi giải bài tập chúng ta nên áp dụng định luật bảo toàn nguyên tố, bảo toàn khối lượng ...
Ví dụ minh họa
Ví dụ 1: Đốt cháy hoàn toàn 6,8 gam khí H2S thu được V lit SO2 (đktc) và m gam hơi nước. Hấp thụ toàn bộ SO2 ở trên vào 200 gam dung dịch NaOH 5,6% thì thu được dung dịch Y. Nồng độ phần trăm của chất tan có phân tử khối lớn hơn trong Y là:
A. 5,04%. B. 4,74%
C. 6,24% D. 5,86%
Lời giải:
Sơ đồ phản ứng:
Bảo toàn nguyên tố S
Ta có:
Bảo toàn nguyên tố S: nNaHSO3 + nNa2SO3 = nSO2 = 0,2 mol
Bảo toàn nguyên tố Na: nNaHSO3 + 2nNa2SO3 = nNaOH = 0,28 mol
mdd sau pư = mddNaOH + mSO2 = 200 + 0,2.64 = 212,8 gam
⇒ Đáp án B
Ví dụ 2: Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Gía trị của m là:
A. 16,5 gam. B. 27,5 gam.
C. 14,6 gam. D. 27,7 gam.
Lời giải:
Ta có:
Bảo toàn nguyên tố S: nK2S = nH2S = 0,15 mol (1)
Bảo toàn nguyên tố K:
nKOH ban đầu = 2nK2S + nKOH dư
⇒ nKOH dư = 0,5 – 0,15.2 = 0,2 mol (2)
Từ (1), (2) ⇒ mrắn = mK2S + mKOH dư
⇒ mrắn = 0,15.110 + 0,2.56 = 27,7gam
⇒ Đáp án D
Dạng 7: Bài toán H2S, SO2 tác dụng với chất oxi hóa mạnh
Phương pháp giải
+ H2S, SO2 có tính khử khi tác dụng chất có tính oxi hóa mạnh như dung dịch KMnO4, dung dịch Br2 ... thì nguyên tử lưu huỳnh 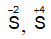
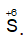
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4;
H2S + 4Br2 + 4H2O → 8HBr + H2SO4;
SO2 + Br2 + 2H2O → 2HBr + H2SO4;
+ Khi giải bài tập chúng ta nên áp dụng định luật bảo toàn nguyên tố, bảo toàn electron, bảo toàn khối lượng ...
Ví dụ minh họa
Ví dụ 1: Hấp thụ V lit (đktc) hỗn hợp khí X gồm H2S và SO2 bằng một lượng vừa đủ 850ml dung dịch Br2 1M thu được dung dịch Y. Cho một lượng dư BaCl2 vào dung dịch Y thu được 93,2 gam kết tủa trắng. Phần trăm khối lượng của H2S trong hỗn hợp X là:
A. 37,50%. B. 62,50%.
C. 75,83%. D. 24,17%.
Lời giải:
Sơ đồ bài toán:
Phương trình phản ứng:
H2S + 4Br2 + 4H2O → 8HBr + H2SO4;
SO2 + Br2 + 2H2O → 2HBr + H2SO4;
H2SO4 + BaCl2 → BaSO4↓(trắng) + HCl;
Bảo toàn nguyên tố S
Bảo toàn electron
Từ (1), (2) ⇒ nH2S = 0,15 mol; nSO2 = 0,25 mol
⇒ Đáp án D
Ví dụ 2: Đốt cháy hoàn toàn V lít khí H2S (đktc) bằng một lượng oxi vừa đủ thu được khí Y. Hấp thụ hết Y cần vừa đủ 200 ml dung dịch KMnO4 1M. Giá trị của V là:
A. 0,2 lít B. 4,48 lít
C. 0,5 lít D. 11,2 lít
Lời giải:
Sơ đồ bài toán:
Phương trình phản ứng:
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4;
Bảo toàn nguyên tố S: nH2S = nSO2
Bảo toàn electron: 2nSO2 = 5nKMnO4
⇒ nH2S = nSO2 = 0,2.(5/2) = 0,5 mol
⇒ VH2S = 0,5.22,4 = 11,2 lít
⇒ Đáp án D
Dạng 8: Bài toán oleum, pha loãng dung dịch
Phương pháp giải
+ Oleum: H2SO4.nSO3
+Khi pha loãng hoặc trộn lẫn các dung dịch không phản ứng với nhau ta nên sử dụng sơ đồ đường chéo...
Ví dụ minh họa
Ví dụ 1: Cho 38,7 gam oleum H2SO4.2SO3 vào 100 gam dung dịch H2SO4 30%, thu được dung dịch X. Nồng độ phần trăm của H2SO4 trong X là:
A. 67,77%. B. 53,43%.
C. 74,10%. D. 32,23%.
Lời giải:
Ta xem H2SO4.2SO3 là dung dịch H2SO4 có nồng độ là:
Sơ đồ đường chéo:
⇒ Đáp án B
Ví dụ 2: Hoà tan 67,6 gam oleum H2SO4.xSO3 vào nước thu được dung dịch X. Sau đó cho từ từ một lượng dư BaCl2 vào X thấy có 186,4 gam kết tủa trắng. Công thức của oleum là
A. H2SO4.SO3. B. H2SO4.2SO3.
C. H2SO4.3SO3. D. H2SO4.4SO3.
Lời giải:
Cách 1:
Phương trình phản ứng:
H2SO4.xSO3 + xH2O → (x+1)H2SO4.
H2SO4 + BaCl2 → BaSO4↓(trắng) + 2HCl.
Ta có:
⇒ Oleum: H2SO4.3SO3
⇒ Đáp án C
Cách 2:
Bảo toàn nguyên tố S
⇒ Oleum: H2SO4.3SO3
⇒ Đáp án C
Dạng 9: Bài toán tính axit mạnh của H2SO4 loãng
Phương pháp giải
H2SO4 loãng là một axit mạnh ⇒ mang đầy đủ tính chất hóa học của axit
+ Tác dụng với kim loại:
2M + xH2SO4 → M2(SO4)x + xH2 (x là hóa trị thấp nhất của kim loại).
( M là kim loại đứng trước H trong dãy hoạt động hóa học)
+ Bazơ, oxit kim loại tác dụng với H2SO4 loãng:
2M(OH)x + xH2SO4 → M2(SO4)x + 2xH2O.
M2Ox + xH2SO4 → M2(SO4)x + xH2O.
+ Bản chất là đây là phản ứng trao đổi, ta thấy sự kết hợp của 1OH- và 1H+ tạo 1H2O; hoặc 1O kết hợp với 2H tạo ra 1H2O.
+ Khi giải bài tập phần này ta nên áp dụng phương pháp tăng giảm khối lượng, cũng như áp dụng linh hoạt các định luật bảo toàn electron, khối lượng, nguyên tố.
Ví dụ minh họa
Ví dụ 1: Hoà tan hoàn toàn 6,48 gam hỗn hợp X gồm Mg và kim loại M, có khối lượng bằng nhau, trong dung dịch H2SO4 loãng dư thu được dung dịch Y và 7,056 lit H2 (đktc). Kim loại M là:
A. Ca B. Al
C. Fe D. Cu
Lời giải:
Gọi k là hóa trị của kim loại M.
nH2 = 7,056/22,4 = 0,315 mol
Bảo toàn electron ⇒ 2nMg + k.nM = 2nH
⇒ Đáp án B
Ví dụ 2: Cho 855 gam dung dịch Ba(OH)2 10% vào 200 gam dung dịch H2SO4 thu được kết tủa và dung dịch X. Để trung hoà dung dịch X người ta phải dùng 125ml dung dịch NaOH 25% (d = 1,28). Nồng độ phần trăm của dung dịch H2SO4 là:
A. 98% B. 25%
C. 49% D. 50%
Lời giải:
Phương trình phản ứng:
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O.
2NaOH + H2SO4 → Na2SO4 + 2H2O.
Ta có:
⇒ Đáp án C
Dạng 10: Bài toán tính oxi hóa mạnh của dung dịch H2SO4 đặc
Phương pháp giải
+ H2SO4 đặc có tính oxi hóa mạnh, nó oxi hóa hầu hết kim loại (trừ Au, Pt...), nhiều phi kim như C, P, S..., và nhiều hợp chất như FeO, C12H22O11, H2S... Trong các phản ứng đó, nguyên tử bị khử về số oxi hóa thấp hơn như , ,
+ Khi giải bài tập phần này ta nên áp dụng linh hoạt các định luật bảo toàn electron, khối lượng, nguyên tố...
Ví dụ minh họa
Ví dụ 1: Hoà tan hoàn toàn 14,6 gam hỗn hợp kim loại X gồm Al, Zn bằng dung dịch H2SO4 đặc nóng thu được dung dịch Y và thoát ra 12,32 lit khí SO2 (đktc), sản phẩm khử duy nhất. Cô cạn cẩn thận dung dịch Y thu được m gam muối sunfat khan. Gía trị của m là:
A. 118,7 gam B. 53,0 gam
C. 100,6 gam D. 67,4 gam
Lời giải:
Cách 1:
Phương trình phản ứng:
Gọi x, y lần lượt là số mol Al2(SO4)3 , ZnSO4 .
Từ khối lượng hỗn hợp kim loại và số mol SO2 ta có hệ :
= 0,15.342 + 0,1.161 = 67,4 gam
⇒ Đáp án D
Cách 2: Sử dụng định luật bảo toàn
Bảo toàn electron : 3nAl + 2nZn = 2nSO2 = 2.(12,32/22,4) = 1,1
Khối lượng kim loại: 27nAl + 65nZn = 14,6
⇒ nAl = 0,3 mol; nZn = 0,1 mol
Bảo toàn nguyên tố Al ta có: nAl2(SO4)3 = 1/2nAl = 0,15 mol
Bảo toàn nguyên tố Zn ta có: nZnSO4 = nZn = 0,1
= 0,15.342 + 0,1.161 = 67,4 gam
⇒ Đáp án D
Ví dụ 2: Khi cho 7,2 gam Al tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối Al2(SO4)3, H2O và sản phẩm khử X. Vậy X là:
A. SO2. B. S.
C. H2S. D. SO2, H2S
Lời giải:
Vì sản phẩm khử của H2SO4 đặc có nhiều dạng như SO2, S, H2S nên bài toán sử dụng cách truyền thống (viết phương trình, cân bằng và đặt ẩn) sẽ không khả thi. Vì vậy sử dụng định luật bảo toàn là cách hợp lí.
Gọi sản phẩm khử là X và k là số electron mà H2SO4 nhận để tạo ra X.
Sơ đồ phản ứng: Al + H2SO4 đặc → Al2(SO4)3 + X + H2O ;
Bảo toàn nguyên tố Al:
(Các sản phẩm khử của H2SO4 đều chứa 1 nguyên tử S nên nX = nS)
Bảo toàn nguyên tố S:
Bảo toàn electron
⇒ X là H2S
⇒ Đáp án C
Dạng 11: Bài toán hiệu suất điều chể hợp chất của lưu huỳnh
Phương pháp giải
+ Để sản xuất axit sunfuric người ta chủ yếu sử dụng quặng pirit sắt (FeS2), và qua 3 giai đoạn như sau:
+ Trong thực tế, quá trình sản xuất luôn có hiệu suất H = a% < 100%.
Chú ý: Khi bài toán cho hiệu suất và yêu cầu xác định lượng chất ta cứ tính toán bình thường, sau đó lấy kết quả nhân với a%(nếu chất cần tính ở phía sau phản ứng), hoặc chia cho a% (nếu chất cần tính ở phía trước phản ứng).
Ví dụ minh họa
Ví dụ 1: Có một loại quặng pirit chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn axit sunfuric 98% thì cần m tấn quặng pirit trên và biết hiệu suất của cả quá trình sản xuất H2SO4 là 90%. Gía trị của m là:
A. 69,44 tấn B. 68,44tấn
C. 67,44 tấn D. 70,44tấn
Lời giải:
Phương trình phản ứng:
Ta có: mH2SO4 = 100.98% = 98 tấn ⇒ nH2SO4 = 1
Bảo toàn nguyên tố S: ⇒ 2nFeS2 = nH2SO4 ⇒ nFeS2 = 0,5
⇒ mFeS2 = 0,5.120 = 60 tấn ⇒ mquặng = 60 : 96% = 62,5 tấn
H = 90% ⇒ mquặng dùng = m = 62,5 : 90% = 69,44 tấn
⇒ Đáp án A
Ví dụ 2: Nung một hỗn hợp X gồm SO2 và O2 có tỉ khối so với O2 là 1,6 với xúc tác V2O5 thu được hỗn hợp Y. Biết tỉ khối của X so với Y là 0,8. Tính hiệu suất của phản ứng tổng hợp SO3 ?
A. 66,7%. B. 50%.
C. 75%. D. 80%.
Lời giải:
Sơ đồ bài toán:
Sơ đồ đường chéo:
Phương trình phản ứng
Ta có:
Hiệu suất phản ứng:
⇒ Đáp án A
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- 7 dạng bài tập Halogen trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Nguyên tử Hóa 10 trong đề thi Đại học (có lời giải)
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học (có lời giải)
- 3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học (có lời giải)
- Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

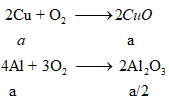
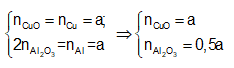
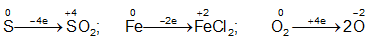
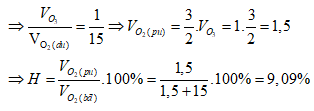
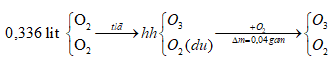
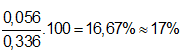
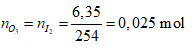
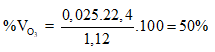
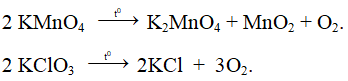
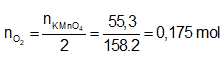
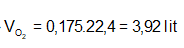
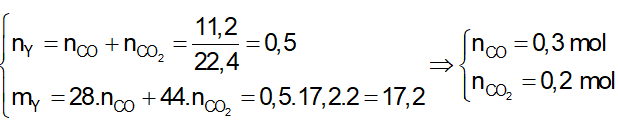
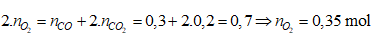
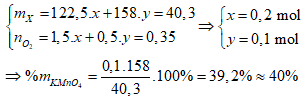
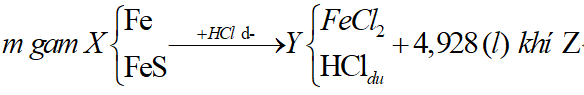
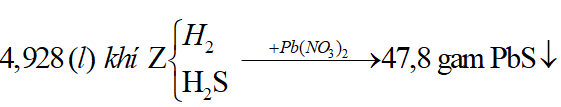
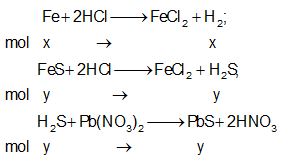
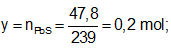
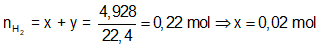
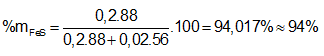
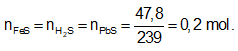
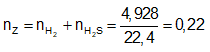
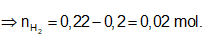
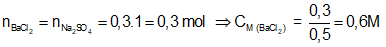
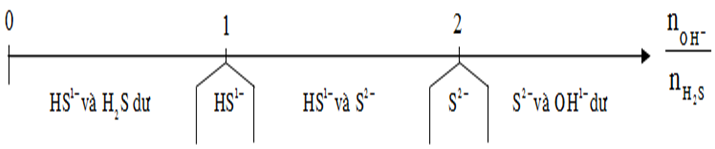
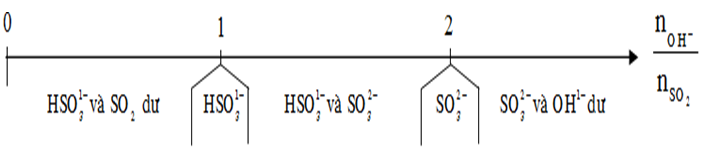
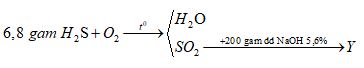
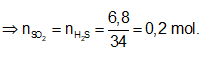
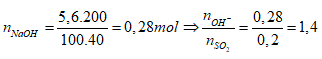
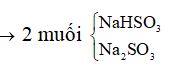
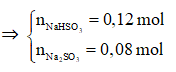
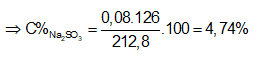
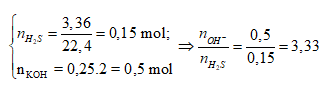
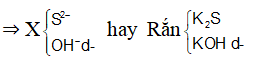
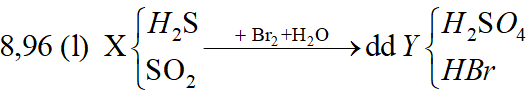
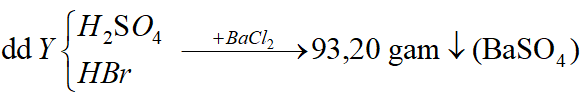
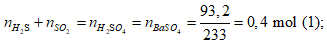
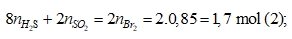
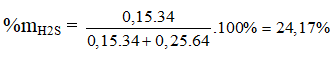
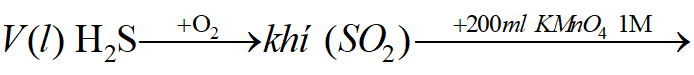
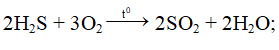
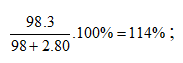
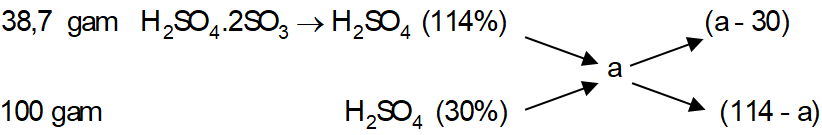
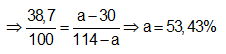
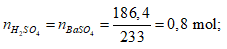
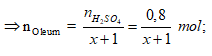
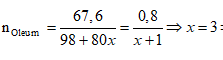
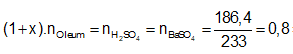
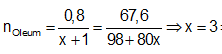
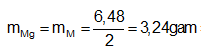
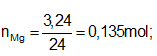
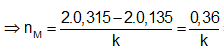
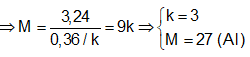
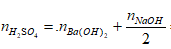
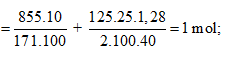
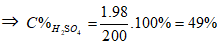
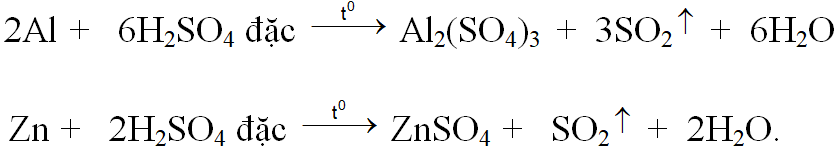
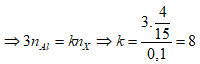
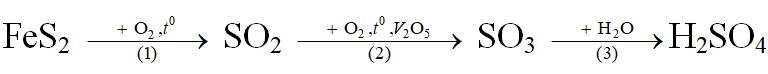
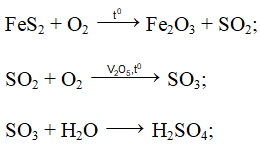
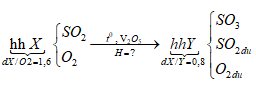
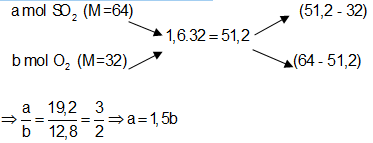
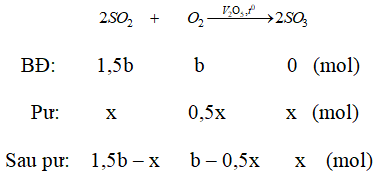
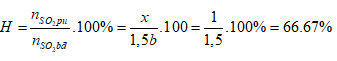



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

