7 dạng bài tập Halogen trong đề thi Đại học (có lời giải)
Với 7 dạng bài tập Halogen trong đề thi Đại học có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Halogen trong đề thi Đại học.
7 dạng bài tập Halogen trong đề thi Đại học (có lời giải)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Dạng 1: Bài toán về halogen tác dụng với kim loại
Phương pháp giải
M + nX2 → 2Mn
( Với F, Cl, Br đưa kim loại lên số oxi hóa cao, I đưa kim loại lên số oxi hóa thấp hơn)
Với bài toán này chúng ta nên sử dụng phương pháp bảo toàn khối lượng và bảo toàn e:
mM + mX2 = mMuối
ne cho = ne nhận
Ví dụ minh họa
Ví dụ 1: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít. B. 6,72 lít.
C. 17,92 lít. D. 11,2 lít.
Lời giải:
Bảo toàn khối lượng:
mCl2 = mmuối – mkim loại = 40,3 – 11,9 = 28,4g
⇒ VCl2 = 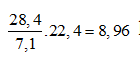
⇒ Đáp án A
Ví dụ 2: Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68%. B. 24,32%.
C. 51,35%. D. 48,65%.
Lời giải:
Gọi nCl2 = x mol; nO2 = y mol
⇒ x + y = 7,84 : 22,4 = 0,35 mol (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mO2 + mCl2 = mZ – mY = 30,1 – 11,1 = 19gam
⇒ 71x + 32y = 19g (2)
Từ (1) & (2) ⇒ x = 0,2; y = 0,15
Qúa trình cho e:
Mg → Mg2+ + 2e Al → Al3+ + 3e
a → 2a (mol) b → 3b (mol)
Qúa trình nhận e:
Cl2 + 2e → 2Cl- O2 + 4e → 2O2-
0,2 → 0,4 (mol) 0,15 → 0,6 (mol)
Bảo toàn e ta có: 2a + 3b = 0,4 + 0,6 = 1 mol (*)
mMg + mAl = 24a + 27b = 11,1 (**)
Từ (*) & (**) ⇒ a = 0,35; b = 0,1
%m Al = 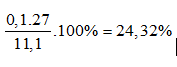
⇒ Đáp án B
Dạng 2: Bài toán halogen mạnh đẩy halogen yếu ra khỏi muối
Phương pháp giải
+ Các bài toán sẽ được xây dựng dựa trên 3 phương trình hóa học:
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
+ Sau phản ứng, một ion halogen này bị thay thế bởi một ion halogen khác. Nên ta có thể sử dụng phương pháp tăng giảm khối lượng để giải quyết bài toán.
Ví dụ minh họa
Ví dụ 1: Sục khí clo dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Thể tích khí clo đã tham gia phản ứng với 2 muối trên (đo ở đktc) là:
A. 4,48 lít. B. 3,36 lít.
C. 2,24 lít. D. 1,12 lít.
Lời giải:
Ta thấy 1 mol muối 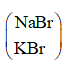
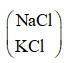
Theo đề bài khối lượng muối giảm 4,45g ⇒ nmuối = 4,45 : 44,5 = 0,1 mol
nCl2 = 1/2nmuối = 0,05 mol
⇒ VCl2 = 0,05.22,4 = 1,12 lít
⇒ Đáp án D
Ví dụ 2: Hỗn hợp X gồm NaBr và NaI. Cho hỗn hợp X tan trong nước thu được dung dịch A. Nếu cho brom dư vào dung dịch A, sau phản ứng hoàn toàn, cô cạn thấy khối lượng muối khan thu được giảm 7,05 gam. Nếu sục khí clo dư vào dung dịch A, phản ứng hoàn toàn, cô cạn dung dịch thấy khối lượng muối khan giảm 22,625 gam. Thành phần % khối lượng của một chất trong hỗn hợp X là:
A. 64,3%. B. 39,1%.
C. 47,8%. D. 35,9%.
Lời giải:
Thí nghiệm 1:
Br2 + 2NaI → 2NaBr + I2
Ta thấy: Cứ 1 mol muối NaI → 1 mol NaBr giảm 127 – 80 = 47g
Theo đề bài khối lượng muối giảm 7,05g ⇒ nNaI = 7,05 : 47 = 0,15 mol
Thí nghiệm 2:
Ta thấy 1 mol NaBr → 1 mol NaCl giảm 44,5g
1 mol NaI → 1 mol NaCl giảm 91,5g
Theo giả thiết khối lượng muối giảm 22,625g
⇒ nNaBr x 44,5 + nNaI x 91,5 = 22,625g
Mà nNaI = 0,15 mol ⇒ nNaBr = 0,2 mol
⇒ %mNaBr =
⇒ Đáp án C
Dạng 3: Bài toán về phản ứng oxi hóa khử của axit HCl
Phương pháp giải
+ HCl thể hiện tính oxi hóa: Khi tác dụng với kim loại
2M + 2nHCl → 2MCln+ H2
(M là kim loại đứng trước H trong dãy hoạt động hóa học; n là hóa trị thấp nhất của kim loại)
Khi giải bài toán này thường sử dụng định luật bảo toàn e, định luật bảo toàn khối lượng để giải:
mmuối = mkim loại + mCl-
nCl- = nHCl = 2nH2
+ HCl thể hiện tính khử: Khi tác dụng với các chất oxi hóa mạnh (KMnO4; KClO3; MnO2; ...)
Khi giải bài toán này thường sử dụng đinh luật bảo toàn e: ne cho = ne nhận
Ví dụ minh họa
Ví dụ 1: Cho 12 gam hỗn hợp X gồm Al và Fe vào 100ml dung dịch HCl 2M đến phản ứng hoàn toàn thu được khí H2 và 7,0 gam chất rắn chưa tan. Thể tích dung dịch HCl 2M tối thiểu cần dung để hòa tan hết 12 gam hỗn hợp X là:
A. 0,225 lít. B. 0,275 lít.
C. 0,240 lít. D. 0,200 lít.
Lời giải:
+ Gọi nAl, nFe phản ứng lần lượt là x, y.
+ Phương trình phản ứng:
Ta có: 27x + 56y = 12 – 7 = 5g (1)
nHCl = 3x + 2y = 0,2 mol (2)
⇒
⇒ 7g không tan là Fe dư; nFe dư = 0,125 mol
nHCl cần dùng = 3nAl + 2 nFe
= 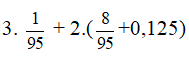
⇒ VHCl = 0,45 : 2 = 0,225 lít
⇒ Đáp án A
Ví dụ 2: Hòa tan hoàn toàn 9,95 gam hỗn hợp X gồm Na, K và Ba vào 100 ml dung dịch HCl 1M thu được dung dịch Y và 2,24 lít khí H2 (đo ở đktc). Cô cạn dung dịch Y thu được m gam chất rắn. Giá trị của m là
A.15,2. B. 13,5.
C. 17,05. D. 11,65.
Lời giải:
+ Kim loại kiềm, kiềm thổ ngoài phản ứng với HCl, chúng còn có phản ứng với H2O trong dung dịch.
+ Phương trình phản ứng tổng quát:
2M + 2nHCl → 2MCln + nH2 ↑
2M + 2nH2O → 2M(OH)n + nH2 ↑
⇒ Đáp án A
Ví dụ 3: Hòa tan hoàn toàn 52,2 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 ở đktc?
A. 11,2. B. 13,44.
C. 8,96. D. 6,72.
Lời giải:
⇒ Đáp án B
Ví dụ 4: Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là
A. 6,72. B. 8,4.
C. 3,36. D. 5,6.
Lời giải:
nKMnO4 = 23,7 : 158 = 0,15 mol
Qúa trình nhận e:
Mn+7 + 5e → Mn+2
0,15 → 0,75 (mol)
Qúa trình cho e:
2Cl- → Cl2 + 2e
Bảo toàn e ta có: nCl2 = 1/2 ne nhận = 0,375 mol
⇒ VCl2 = 0,375.22,4 = 8,4 lít
⇒ Đáp án B
Dạng 4: Bài toán về tính axit của HCl
Phương pháp giải
Dung dịch HCl là một axit mạnh nên có khả năng tác dụng với: basic oxide; bazơ; muối. Bản chất là các phản ứng trao đổi nên có thể giải bài toán theo phương pháp tăng giảm khối lượng; phương pháp bảo toàn điện tích.
Ví dụ minh họa
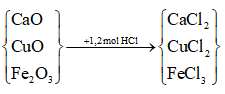
Ví dụ 1: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 80,2. B. 70,6.
C. 49,3. D. 61,0.
Lời giải:
Bảo toàn điện tích ta có:
nCl- = 2nO2- ( Cùng bằng điện tích cation)
Mà nCl- = nHCl ⇒ nO = 1/2 nHCl = 0,6 mol
mkim loại = moxit – mO = 37,6 – 0,6.16 = 28g
mmuối = mkim loại + mCl- = 28 + 1,2.35,5 = 70,6g
⇒ Đáp án B
Ví dụ 2: Để trung hoà 200 ml dung dịch NaOH 1,5M thì thể tích dung dịch HCl 0,5M cần dùng là bao nhiêu?
A. 0,5 lít. B. 0,4 lít.
C. 0,3 lít. D. 0,6 lít.
Lời giải:
nNaOH = 0,2.1,5 = 0,3 mol
NaOH + HCl → NaCl + H2O
0,3 → 0,3 (mol)
⇒ VHCl = 0,3 : 0,5 = 0,6 lít
⇒ Đáp án D
Ví dụ 3: Hoà tan 10 gam hỗn hợp 2 muối carbonate của kim loại hoá trị hai và hoá trị ba bằng dung dịch HCl, ta thu được dung dịch A và 0,672 lít khí bay ra ở đktc. Khi cô cạn dung dịch A thì khối lượng muối khan thu được là :
A. 10,33 gam. B. 9,33 gam.
C. 11,33 gam. D. 12,33 gam.
Lời giải:
Bảo toàn điện tích ta có:
2nCO32- = nCl- (cùng = điện tích cation) = 0,06 mol
mkim loại = mmuối carbonate – mCO32- = 10 – 0,03.60 = 8,2g
mmuối = mkim loại + mCl- = 8,2 + 0,06.35,5 = 10,33
⇒ Đáp án A
Dạng 5: Bài tập muối halogen tác dụng với AgNO3
Phương pháp giải
+ Các muối halogenua tạo kết tủa với AgNO3 màu kết tủa đậm dần tử Cl- đến I- ( AgCl: trắng; AgBr: vàng nhạt; AgI: vàng đậm)
+ Riêng F- không tạo kết tủa với Ag+ (do AgF tan)
Ví dụ minh họa
Ví dụ 1: Cho lượng dư dung dịch AgNO3 vào dung dịch hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 14,35 gam. B. 10,8 gam.
C. 21,6 gam. D. 27,05 gam.
Lời giải:
Chỉ có NaCl tạo kết tủa với AgNO3
m↓ = mAgCl = 0,1.143,5 = 14,35g
⇒ Đáp án A
Ví dụ 2: Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là:
A. 68,2 gam. B. 28,7 gam.
C. 10,8 gam. D. 57,4 gam.
Lời giải:
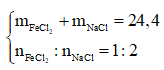
Bảo toàn nguyên tố Cl: nAgCl = 2nFeCl2 + nNaCl = 0,4 mol
m = mAgCl + mAg = 0,4.143,5 + 0,1.108 = 68,2g
⇒ Đáp án A
Dạng 6: Bài toán xác định nguyên tố kim loại, phi kim
Phương pháp giải
+ Đối với các bài toán tìm kim loại đã biết hóa trị, ta chỉ cần tìm khối lượng nguyên tử (M) kim loại đó, rồi suy ra tên kim loại.
+ Đối với các bài toán tìm kim loại chưa biết hóa trị, ta tìm mối liên hệ giữa khối lượng nguyên tử (M) và hóa trị (n) của nguyên tố đó, sau đó lập bảng tìm M, với n = 1; 2; 3, từ đó suy ra tên kim loại.
+ Đối với bài toán xác định 2 nguyên tố cùng nhóm và thuộc 2 chu kì liên tiếp, ta tìm giá trị nguyên tử khối trung bình 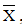
Ví dụ minh họa
Ví dụ 1: Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg. B. Al.
C. Fe. D. Zn.
Lời giải:
2M + nCl2 → 2MCln
Pt: 2M → 2(M + 35,5n) (g)
Đề bài: 10,8 → 53,4 (g)
⇒
⇒ n = 3; M = 27 (Al)
⇒ Đáp án B
Ví dụ 2: Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
A. Al. B. Na.
C. Ca. D. K.
Lời giải:
Bài toán xảy ra 1 chuỗi phản ứng oxi hóa – khử, ta chỉ quan tâm số oxi hóa trạng thái đầu và trạng thái cuối của các nguyên tố có sự thay đổi số oxi hóa.
Gọi nM = 2x ; nMg = 3x mol
Qúa trình cho – nhận e:
M → Mn+ + ne Cl2 + 2e → 2Cl-
2x → 2nx (mol) 0,15 → 0,3
Mg → Mg2+ + 2e 2H+ + 2e → H2
3x → 6x (mol) 0,1 ← 0,05 (mol)
Ta có: mX = 2x.M + 24.3x = 7,5g (1)
Bảo toàn e: 2nx + 6x = 0,3 + 0,1 = 0,4 mol (2)
Chia phương trình (1) cho (2)
Ta có bảng:
| n | 1 | 2 | 3 |
| M | 39(K) | 57,75 (loại) | 76,5(loại) |
⇒ M là K
⇒ Đáp án D
Ví dụ 3: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Thành phần phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 47,2%. B. 52,8%.
C. 58,2%. D. 41,8%.
Lời giải:
Giả sử Y không phải Flo
Gọi CTTB của X và Y là
Na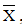
23 + 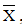
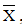
6,03 → 8,61 (g)
⇒ 8,61.(23 + 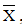
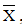
⇒ 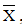
⇒ X là Clo, Y là Flo
Kết tủa chỉ gồm AgCl; nAgCl = nNaCl = 8,61 : 143,5 = 0,06 mol
% mNaCl = 0,06.58,5 : 6,03 . 100% = 58,2% ⇒ % mNaF = 41,2%
⇒ Đáp án D
Dạng 7: Hiệu suất phản ứng
Phương pháp giải
Tính hiệu suất theo chất tham gia:
Tính hiệu suất theo sản phẩm:
Ví dụ minh họa
Ví dụ 1: Cho 3 lít Cl2 phản ứng với 2 lít H2; hiệu suất phản ứng đạt 80%. Phần trăm thể tích Cl2 trong hỗn hợp khí sau phản ứng là: (các thể tích khí được đo ở cùng điều kiện t0, p)
A. 28%. B. 64%.
C. 60%. D. 8%.
Lời giải:
Cl2 + H2 → 2HCl
VH2 < VCl2 ⇒ Hiệu suất tính theo H2
VCl2 pư = VH2 pư = VH2. H = 2. 80% = 1,6 lít
VCl2 dư = 3 – 1,6 = 1,4 lít
Vsau phản ứng = VHCl + VH2 dư + VCl2 dư = 2.1,6 + 0,4 + 1,4 = 5 lít
⇒ Đáp án A
Ví dụ 2: Khối lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần để điều chế 9,36 gam muối NaCl là (biết H = 80%)
A. 3,68 gam và 2,24 lít. B. 3,68 gam và 1,792 lít.
C. 4,6 gam và 1,792 lít. D. 4,6 gam và 2,24 lít.
Lời giải:
⇒ mNa thực tế = 0,16.23 : 80% = 4,6g
VCl2 thực tế = (0,08.22,4) : 80% = 2,24 lít
⇒ Đáp án D
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- 11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Nguyên tử Hóa 10 trong đề thi Đại học (có lời giải)
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học (có lời giải)
- 3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học (có lời giải)
- Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

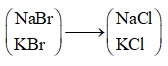
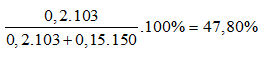
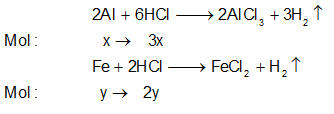
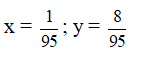
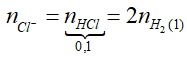
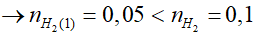
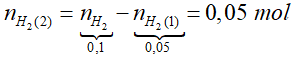
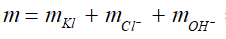
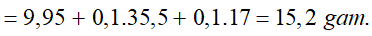
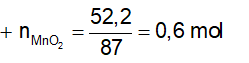
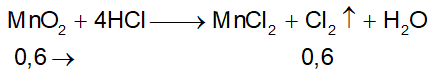
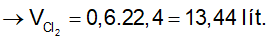
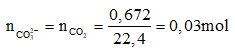
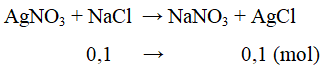
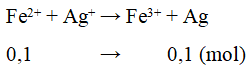
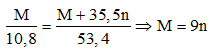
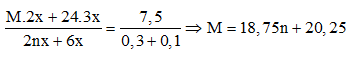
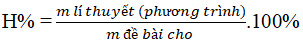
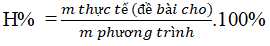
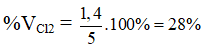
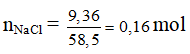
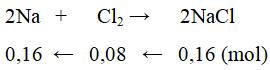



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

