6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
Với 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Bảng tuần hoàn trong đề thi Đại học.
6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Dạng 1: Mối liên hệ giữa vị trí với cấu tạo nguyên tử, nguyên tố, tính chất hợp chất
Phương pháp giải
- Số thứ tự ô nguyên tố = tổng số e của nguyên tử.
- Số thứ tự chu kì = số lớp e.
- Số thứ tự nhóm:
+ Nếu cấu hình e lớp ngoài cùng có dạng nsanpb (a = 1 → 2 và b = 0 → 6): Nguyên tố thuộc nhóm (a + b)A.
+ Nếu cấu hình e kết thúc ở dạng (n - 1)dxnsy (x = 1 → 10; y = 1 → 2): Nguyên tố thuộc nhóm B:
* Nhóm (x + y)B nếu 3 ≤ (x + y) ≤ 7.
* Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10.
* Nhóm (x + y - 10)B nếu 10 < (x + y).
Ví dụ minh họa
Ví dụ 1: Cho nguyên tử các nguyên tố X1, X2, X3, X4, X5, X6 lần lượt có cấu hình electron như sau:
X1: 1s22s22p63s2
X2: 1s22s22p63s23p64s1
X3: 1s22s22p63s23p64s2
X4: 1s22s22p63s23p5
X5: 1s22s22p63s23p63d64s2
X6: 1s22s22p63s23p4
Các nguyên tố cùng một chu kì là:
A. X1, X3, X6 B. X2, X3, X5
C. X1, X2, X6 D. X3, X4
Lời giải:
Các nguyên tố cùng một chu kì thì có cùng số lớp electron
⇒ Đáp án B
Ví dụ 2: Giả sử nguyên tố M ở ô số 19 trong bảng tuần hoàn chưa được tìm ra và ô này vẫn còn được bỏ trống. Hãy dự đoán những đặc điểm sau về nguyên tố đó:
a. Tính chất đặc trưng.
b. Công thức oxit. Oxit đó là acidic oxide hay basic oxide?
Lời giải:
a. Cấu hình electron của nguyên tố đó là: 1s22s22p63s23p64s1
⇒ Tính chất đặc trưng của M là tính kim loại.
b. Nguyên tố đó nằm ở nhóm IA nên công thức oxit là M2O. Đây là một basic oxide.
Ví dụ 3: Nguyên tử R tạo được Cation R+. Cấu hình e của R+ ở trạng thái cơ bản là 3p6. Tổng số hạt mang điện trong R là.
A.18 B.22
C.38 D.19
Lời giải:
Cấu hình của R+ là 3p6
⇒ của R sẽ là 3p64s1
⇒ R có cấu hình đầy đủ là 1s22s22p63s23p64s1
⇒ Tổng hạt mang điện trong R là ( p + e ) = 38
⇒ Đáp án C
Ví dụ 4: X, Y là hai kim loại có electron cuối cùng là 3p1 và 3d6.
1. Dựa vào bảng tuần hoàn, hãy xác định tên hai kim loại X, Y.
2. Hòa tan hết 8,3 gam hỗn hợp X, Y vào dung dịch HCl 0,5M (vừa đủ), ta thấy khối lượng dung dịch sau phản ứng tăng thêm 7,8 gam. Tính khối lượng mỗi kim loại và thể tích dung dịch HCl đã dùng.
Lời giải:
1. Phân mức năng lượng của nguyên tử X và Y lần lượt là:
1s22s22p63s23p1 và 1s22s22p63s23p64s23d6.
Cấu hình electron của nguyên tử X và Y lần lượt là:
1s22s22p63s23p1 và 1s22s22p63s23p63d64s2.
Dựa vào bảng tuần hoàn ta tìm được X là Al và Y là Fe.
2. Gọi số mol các chất trong hỗn hợp: Al = a mol; Fe = b mol.
Ta có: 27a + 56b = 8,3 (1)
Khối lượng dung dịch sau phản ứng tăng thêm 7,8 gam nên: 8,3 – mH2= 7,8.
⇒ mH2 = 0,5 gam ⇒ nH2 = 0,25 mol
⇒ 1,5a + b = 0,25(4)
Từ (1) và (2) ta tìm được: a = 0,1 mol; b = 0,1 mol.
mAl = 270,1 = 2,7(gam); mFe = 560,1 = 5,6 (gam); VHCl = 1 (lít).
Dạng 2: So sánh tính chất các nguyên tố lân cận và hợp chất oxit, hiđroxit của chúng
Phương pháp giải
Những đại lượng và tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Bán kính nguyên tử
+ Năng lượng ion hóa thứ nhất
+ Độ âm điện
+ Tính kim loại, tính phi kim
+ Tính axit – bazơ của oxit và hiđroxit
+ Hóa trị cao nhất của nguyên tố với oxi và hóa trị của nguyên tố phi kim với hiđro
Ví dụ minh họa
Ví dụ 1: Cho các nguyên tố O, C, N, F, B, Be, Li. Thứ tự sắp xếp các nguyên tố theo chiều tăng dần tính phi kim là:
A. O, C, N, F, B, Be, Li
B. Li, Be, B, C, N, O, F
C. Li, Be, B, F, N, C, O
D. Li, Be, B, N, C, O, F
Lời giải:
Trong một chu kì theo chiều tăng của điện tích hạt nhân, tính phi kim của các nguyên tố tăng dần
⇒ Đáp án B
Ví dụ 2: Sắp xếp các oxit Al2O3; Na2O; MgO; SiO2; SO3; P2O5; Cl2O7 theo chiều giảm dần tính bazơ là:
A. Al2O3; Na2O; MgO; SiO2; SO3; P2O5; Cl2O7
B. SiO2; SO3; P2O5; Cl2O7; Al2O3; Na2O; MgO
C. Na2O; MgO; Al2O3; SiO2; P2O5; SO3; Cl2O7
D. SiO2; P2O5; SO3; Cl2O7; Na2O; MgO; Al2O3
Lời giải:
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân tính bazơ của oxit tương ứng giảm dần
⇒ Đáp án C
Dạng 3: Xác định hai nguyên tố thuộc 2 nhóm A liên tiếp
Phương pháp giải
Giả sử ZA < ZB
+ Nếu A và B thuộc cùng 1 chu kỳ thì: ZA – ZB = 1.
+ Nếu A và B không biết có thuộc cùng 1 chu kỳ hay không thì phải dựa vào = Z/2 và ZA << ZB.
Ví dụ minh họa
Ví dụ 1: Hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn, A thuộc nhóm VA. Ở trạng thái đơn chất, A và B không phản ứng với nhau. Tổng số proton trong hạt nhân A và B bằng 23. A và B là
A. P và O B. N và C
C. P và Si D. N và S
Lời giải:
Vì hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn và A thuộc nhóm VA
Nên B thuộc nhóm IVA hoặc nhóm VIA.
Vì ZA + ZB = 23 nên ZA < 23
⇒ A là N (Z = 7) or A là P (Z = 15)
+) Khi A là N thì ZB = 23 -7 = 16 là S thuộc nhóm VIA.
Ở trạng thái đơn chất, N2 và S không phản ứng với nhau.
Do đó cặp nguyên tố N và S thỏa mãn.
+) Khi A là P thì ZB = 23 -15 = 8 là O thuộc nhóm VIA.
Ở trạng thái đơn chất P và O2 có phản ứng với nhau.
Do đó cặp nguyên tố P và O không thỏa mãn.
⇒ Đáp án D
Ví dụ 2: Hai nguyên tố A và B thuộc hai nhóm liên tiếp của bảng tuần hoàn. Tổng số proton của A và B bằng 19. Có bao nhiêu cặp A và B thỏa mãn điều kiện trên
A. 1 B. 2
C. 3 D. 4
Lời giải:
Giả sử ZA < ZB Ta có:
⇒ B thuộc chu kì 3
TH1: A thuộc chu kì 1 (A là Hidro hoặc He)
+ A là Hidro (Z = 1) ⇒ Không thỏa mãn
+ A là He (Z = 2) ⇒ Thỏa mãn
TH2: A thuộc chu kì 2 ⇒ A và B là 2 nguyên tố thuộc 2 chu kì nhỏ liên tiếp và 2 nhóm liên tiếp trong bảng tuần hoàn.
Từ đó ta có
Vậy có 3 trường hợp thỏa mãn điều kiện bài toán.
⇒ Đáp án C
Dạng 4: Xác định hai nguyên tố thuộc cùng 1 nhóm A
Phương pháp giải
Tổng số hiệu nguyên tử 4 < ZT < 32 thì A, B sẽ thuộc các chu kỳ nhỏ hay ZA - ZB = 8.
- Nếu ZT > 32 thì ta phải xét cả 3 trường hợp:
+ A là H.
+ A và B cách nhau 8 đơn vị.
+ A và B cách nhau 18 đơn vị.
Ví dụ minh họa
Ví dụ 1: X và Y là hai nguyên tố trong cùng một nhóm A và ở hai chu kì liên tiếp của bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tử X và Y bằng 30. Cấu hình electron của X là (biết MX < MY)
A. 1s22s22p63s23p64s1
B. 1s22s22p2
C. 1s22s22p63s1
D. [Ar]3d54s1
Lời giải:
Vì X và Y thuộc cùng một nhóm A và ở chu kì liên tiếp nên ta có:
X và Y là hai nguyên tố trong cùng một nhóm A ⇒ X là Na và Y là K
Khi đó cấu hình electron là của Na là 1s22s22p63s1
⇒ Đáp án C
Ví dụ 2: Cho 24,95 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với axit H2SO4 loãng thu được 4,48 lít khí H2 (đktc). Hai kim loại đó là:
A. Ca và Sr B. Sr và Ba
C. Be và Ca D. Ca và Ba
Lời giải:
Gọi công thức chung của hai kim loại thuộc nhóm IIA là
Có phản ứng:
Do đó hỗn hợp cần có 1 kim loại có M < 124,75 và 1 kim loại có khối lượng mol lớn hơn 124,75.
Mà hai kim loại trong hỗn hợp ở hai chu kì liên tiếp và thuộc nhóm IIA.
Nên hai kim loại đó là Sr và Ba
⇒ Đáp án B
Dạng 5: Xác định nguyên tố dựa vào vị trí và tính theo phương trình hóa học
Ví dụ minh họa
Ví dụ 1: Cho 0,64 gam hỗn hợp gồm kim loại M và oxit của nó MO, có số mol bằng nhau, tác dụng hết với H2SO4 loãng. Thể tích khí H2 (đktc) thu được là 0,224 lít. Cho biết M thuộc nhóm IIA. Xác định M là nguyên tố nào sau đây?
A. Mg B. Ca
C. Sr D. Ba
Lời giải:
Các phản ứng:
Vì nM = nMO ⇒ nMO = nM = nH2 = 0,01
⇒ mM + mMO = 0,01(2M + 16) = 0,64
⇔ M = 24 là Mg
⇒ Đáp án A
Ví dụ 2: M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp gồm kim loại M và muối carbonate của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỉ khối của A so với khí hiđro là 11,5. M là:
A. Be B. Ca
C. Ba D. Mg
Lời giải:
Các phản ứng:
Do đó hỗn hợp khí A thu được gồm H2 và CO2.
Gọi:
⇒ mM + mMCO3 = 0,1(2M + 60) = 10,8
⇔ M = 24 là Mg
⇒ Đáp án D
Ví dụ 3: Cho 10 gam kim loại M (thuộc nhóm IIA) tác dụng với nước, thu được 6,11 lit khí hiđro (đo ở 25oC và 1 atm).
a. Hãy xác định tên của kim loại M đã dùng.
b. Cho 4 gam kim loại M vào cốc đựng 2,5lit dung dịch HCl 0,06M thu được dung dịch B.
Tính nồng độ mol/l các chất trong cốc sau phản ứng. Coi thể tích dung dịch trong cốc vẫn là 2,5 l.
Lời giải:
a. Gọi số mol kim loại M là a mol.
nH2 = 0,25(mol) ⇒ a = 0,25
Ta có: mM = 10 ⇒ M = 40(Ca).
b. nCa = 0,1 mol.
Dung dịch B gồm:
CaCl2 = 0,075 mol và Ca(OH)2 = 0,025 mol.
CM CaCl2 = 0,075 : 2,5 = 0,03M ; CM Ca(OH)2 = 0,025 : 2,5 = 0,01M
Dạng 6: Xác định tên nguyên tố dựa vào công thức oxit cao nhất và công thức hợp chất khí với hiđro
Phương pháp giải
Tổng Hóa trị trong hợp chất khí với hidro (nếu có) và hóa trị trong oxit cao nhất của một nguyên tố bằng 8.
|
Nhóm |
I |
II |
III |
IV |
V |
VI |
VII |
|
Oxit cao nhất |
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
|
Hợp chất với hidro |
RH rắn |
RH2 rắn |
RH3 rắn |
RH4 khí |
RH3 khí |
RH2 khí |
RH khí |
Ví dụ minh họa
Ví dụ 1: Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hidro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%. với a : b = 11 : 4. Phát biểu nào sau đây đúng?
A. Phân tử oxit cao nhất của R không phân cực
B. Oxit cao nhất của R ở điều kiện thường là chất rắn
C. Trong bảng tuần hoàn R thuộc chu kì 3
D. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s
Lời giải:
Hợp chất khí với Hidro của R có công thức là RHx (4 ≥ x ≥ 1 ) ⇒ Oxit cao nhất của R là R2O8-x . Theo đề bài ta có:
Ta có:
|
x |
1 |
2 |
3 |
4 |
|
R |
30,42 |
24,28 |
18,14 |
12 (thỏa mãn) |
Vậy R là C
⇒ Hợp chất khí với Hidro là CH4 và Oxit cao nhất là CO2
Nhận xét các đáp án:
A đúng: Do CO2 có cấu trúc mạch thẳng O – C – O nên lực hút của nguyên tử Oxi triệt tiêu lẫn nhau ⇒ CO2 có liên kết cộng hóa trị giữa nguyên tử C và O phân cực nhưng phân tử CO2 không phân cực.
B sai: Ở điều kiện thường CO2 là hợp chất khí.
C sai: Trong bảng tuần hoàn C thuộc chu kì 2.
D sai: Ở trạng thái cơ bản C có 4 electron s.
⇒ Đáp án A
Ví dụ 2: Nguyên tố R là một phi kim, tỉ lệ phần trăm khối lượng của R trong hợp chất khí với hidro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì được 40,05 gam muối. Phân tử khối của muối tạo ra là
A. 267 B. 169
C. 89 D. 107
Lời giải:
* Xác định nguyên tố phi kim R:
+) Nếu hóa trị của R trong oxit cao nhất là chẵn thì ta có công thức của oxit cao nhất là ROn.
Khi đó công thức của hợp chất khí với hidro của R là RH8-2n. Theo giả thiết đề bài ta có:
⇔ 0,4045R + 8 = 11,528n
|
n |
1 |
2 |
3 |
|
R |
8,72 |
37,22 |
65,72 |
Do đó trường hợp này có kết quả thỏa mãn.
+) Nếu hóa trị của R trong oxit cao nhất là lẻ thì ta có công thức oxit cao nhất là R2On.
Khi đó công thức của hợp chất khí với hidro của R là RH8-n. Theo giả thiết đề bài ta có:
⇔ 0,809R + 16 = 11,528n
|
n |
1 |
3 |
5 |
7 |
|
R |
âm |
22,97 |
51,47 |
80 |
Do đó có n = 7 và R = 80 thỏa mãn.
Suy ra R là Br.
* Xác định kim loại M.
Vì Br trong hợp chất muối với kim loại có hóa trị I
Nên gọi công thức của muối thu được là MBrx với x là hóa trị của M. Theo định luật bảo toàn khối lượng ta có:
mBr = mmuối - mM = 40,05 - 4,05 = 36 (gam)
Mà
Do đó muối thu được là AlBr3.
Vậy phân tử khối của muối tạo ra là 27 + 80.3 = 267
⇒ Đáp án A
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- 7 dạng bài tập Halogen trong đề thi Đại học (có lời giải)
- 11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Nguyên tử Hóa 10 trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học (có lời giải)
- 3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học (có lời giải)
- Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

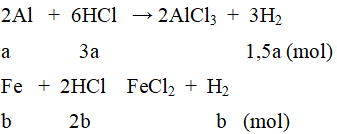
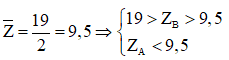
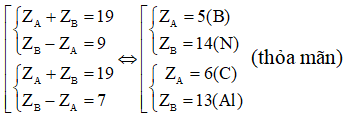
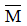
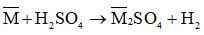
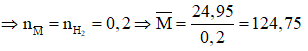
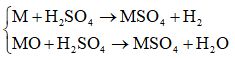
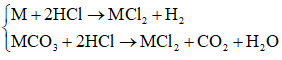
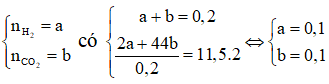
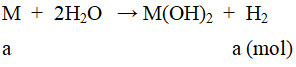
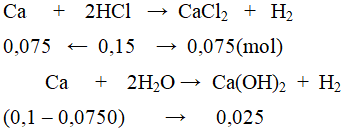
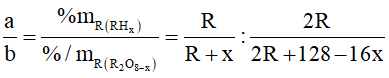
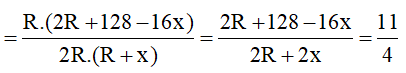
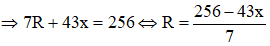
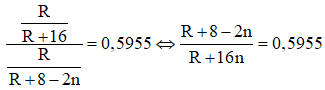
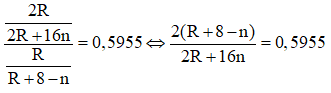
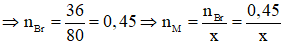
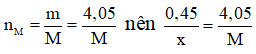
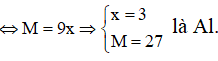



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

