Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
Bài viết Phương pháp Tính nồng độ các chất ở trạng thái cân bằng với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Phương pháp Tính nồng độ các chất ở trạng thái cân bằng.
Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Phương pháp giải
Xét phản ứng đồng thể đơn giản tổng quát:
aA + bB ↔ cC + dD
- Khi hệ đạt trạng thái cân bằng: vthuận = vnghịch
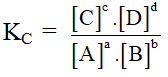
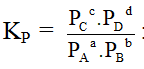
(Nồng độ các chất và áp suất các chất tại thời điểm cân bằng)
- Trong bình kín thì mt = ms 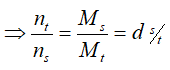
- Bình kín, nhiệt độ không đổi thì
Ví dụ minh họa
Ví dụ 1: Cho phương trình phản ứng :2A(k) + B (k) ↔ 2X (k) + 2Y(k) Người ta trộn 4 chất, mỗi chất 1 mol vào bình kín dung tích 2 lít (không đổi). Khi cân bằng, lượng chất X là 1,6 mol. Nồng độ B ở trạng thái cân bằng lần lượt là :
A. 0,7M B. 0,8M.
C. 0,35M. D. 0,5M.
Lời giải:
Ban đầu có sẵn 1 mol X nên số mol X được tạo ra là 1,6 - 1 = 0,6 mol
2A(k) + B(k) ↔ 2X(k) + 2Y(k)
BĐ (n0): 1 1 1 1 (mol)
⇒ [B] = 0,7 : 3 = 0,35M
⇒ Đáp án C
Ví dụ 2: Trong bình kín dung tích 1 lít, người ta cho vào 5,6 gam khí CO và 5,4 gam hơi nước. Phản ứng xảy ra là :CO + H2O → CO2 + H2. Ở 850oC hằng số cân bằng của phản ứng trên là 1. Nồng độ mol của CO và H2O khi đạt đến cân bằng lần lượt là :
A. 0,2 M và 0,3 M.
B. 0,08 M và 0,2 M.
C. 0,12 M và 0,12 M.
D. 0,08 M và 0,18 M.
Lời giải:
Ban đầu: [CO] = 0,2M; [H2O] = 0,3M
Gọi [CO]pư = Am
Tại cân bằng: [CO] = 0,2 – a; [H2O] = 0,3 – a; [CO2] = a; [H2] = a
a = 0,12 ⇒ [CO] = 0,08M; [CO2] = 0,18M
⇒ Đáp án D
Ví dụ 3: Một bình kín chứa NH3 ở 0oC và 1 atm với nồng độ 1 mol/l. Nung bình kín đó đến 546oC và NH3 bị phân huỷ theo phản ứng :2NH3(k) → N2(k) + 3H2(k). Khi phản ứng đạt tới cân bằng áp suất khí trong bình là 3,3 atm, thể tích bình không đổi. Hằng số cân bằng của phản ứng phân huỷ NH3 ở 546oC là :
A. 1,08.10-4.
B. 2,08.10-4.
C. 2,04.10-3.
D. 1,04.10-4.
Lời giải:
Gọi nồng độ NH3 phản ứng là 2x
Vì thể tích dung dịch không đổi nên:
⇒ x = 0,05
Ta có:
⇒ Đáp án C
Ví dụ 4: Cho cân bằng :N2O4 → 2NO2. Cho 18,4 gam N2O4 vào bình chân không dung tích 5,9 lít ở 27oC, khi đạt đến trạng thái cân bằng, áp suất là 1 atm. Hằng số cân bằng KC ở nhiệt độ này là :
A. 0,040. B. 0,007.
C. 0,00678. D. 0,008.
Lời giải:
nN2O4 = 0,2 mol
Gọi nN2O4 pư = x mol
ncân bằng = 0,2 – x + 2x = 0,2 + x = 0,24 ⇒ x = 0,04 mol
⇒ [NO2] = 0,04 : 5,9 = ; [N2O4] = 8/295
⇒ Đáp án B
Ví dụ 5: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
A. 10 atm. B. 8 atm.
C. 9 atm. D. 8,5 atm.
Lời giải:
(hiệu suất tính theo H2)
Ta có thể tích và nhiệt độ không đổi
⇒ Psau = 10 : 5/4 = 8 atm
⇒ Đáp án B
Bài tập tự luyện
Câu 1: Hỗn hợp X gồm SO2 và O2 được trộn theo tỉ lệ mol 1 : 4. Nung hỗn hợp X với V2O5 một thời gian thu được hỗn hợp Y. Thành phần phần trăm thể tích SO3 trong hỗn hợp Y là . Hiệu suất tổng hợp SO3 là
A. 12,5%.
B. 25%.
C. 55%.
D. 50%.
Câu 2: Khi thực hiện phản ứng ester hoá 1 mol CH3COOH và 1 mol C2H5OH, lượng ester lớn nhất thu được là 2/3 mol. Để đạt hiệu suất cực đại là 80% (tính theo acid) khi tiến hành ester hoá 1 mol CH3COOH cần số mol C2H5OH là (biết các phản ứng ester hoá thực hiện ở cùng nhiệt độ).
A. 0,4.
B. 0,8.
C. 1,6.
D. 3,2.
Câu 3: Cho cân bằng sau:
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O Kc = 4.
Khi cho 1 mol acid tác dụng với 1,6 mol alcohol, khi hệ đạt đến trạng thái cân bằng thì hiệu suất của phản ứng là
A. 50%.
B. 66,67%.
C. 33,33%.
D. 80%.
Câu 4: Cho phản ứng sau:
H2O(g) + CO(g) ⇌ H2(g) + CO2(g)
Ở 700°C hằng số cân bằng là Kc = 1,873. Biết rằng hỗn hợp đầu gồm 0,300 mol H2O và 0,300 mol CO trong bình 10 lít ở 700°C. Nồng độ của H2O và CO ở trạng thái cân bằng lần lượt là
A. 0,01267M.
B. 0,01733M.
C. 0,1267M.
D. 0,1733M.
Câu 5: Một bình kín chứa khí NH3 ở 0°C và 1 atm với nồng độ 1M. Nung bình kín đó đến 546°C, NH3 bị phân hủy theo phản ứng: 2NH3(g) ⇌ N2(g) + 3H2(g). Khi phản ứng đạt tới trạng thái cân bằng, áp suất trong bình là 3,3 atm. Thể tích bình không đổi. Giá trị hằng số cân bằng của phản ứng tại 546°C là
A. 4807.
B. 120.
C. 8,33.10−3.
D. 2,08.10−4.
Câu 6: Một bình kín dung tích không đổi chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,4M và 0,6M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở t°C, H2 chiếm 25% thể tích hỗn hợp thu được. Hằng số cân bằng Kc ở t°C của phản ứng có giá trị là
A. 51,7.
B. 3,125.
C. 2,500.
D. 6,09.
Câu 7: Xét cân bằng: N2O4(g) ⇌ 2NO2(g) ở 25°C.
Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2
A. tăng 9 lần.
B. giảm 3 lần.
C. tăng 4,5 lần.
D. tăng 3 lần.
Câu 8: Khi thực hiện phản ứng ester hoá 1 mol CH3COOH và 1 mol C2H5OH, lượng ester lớn nhất thu được là 2/3 mol. Để đạt hiệu suất cực đại là 90% (tính theo acid) khi tiến hành ester hoá 1 mol CH3COOH cần số mol C2H5OH là (biết các phản ứng ester hoá thực hiện ở cùng nhiệt độ và có phản ứng ester hóa diễn ra như sau: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O)
A. 0,342.
B. 2,925.
C. 2,412.
D. 0,456.
Câu 9: Cho 6 mol N2 và y mol H2 vào bình kín dung tích 4 lít. Khi đạt trạng thái cân bằng N2 tham gia phản ứng là 25%. Đưa bình về nhiệt độ ban đầu thấy áp suất P2 = 21/24 P1. Tìm y và tính Kc.
A. 18; 0,013.
B. 15; 0,02.
C. 16; 0,013.
D. 18; 0,015.
Câu 10: Xét 2 cân bằng hóa học sau:
(1) H2(g) + I2(g) ⇌ 2HI(g)
(2)
Ở nhiệt độ xác định nếu KC của cân bằng (1) bằng 64 thì KC của cân bằng (2) là
A. 4.
B. 0,5.
C. 0,25.
D. 0,125.
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- 7 dạng bài tập Halogen trong đề thi Đại học (có lời giải)
- 11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Nguyên tử Hóa 10 trong đề thi Đại học (có lời giải)
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
- 4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học (có lời giải)
- 3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học (có lời giải)
- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học (có lời giải)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

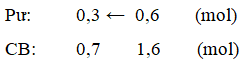
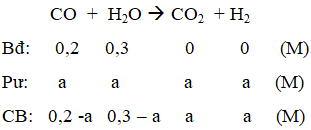
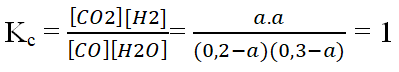
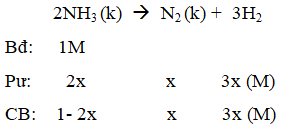
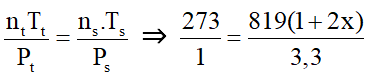
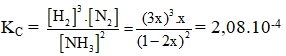
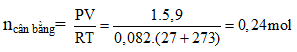
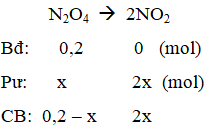
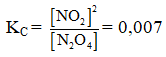
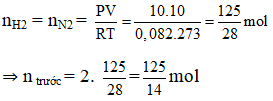
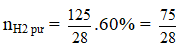
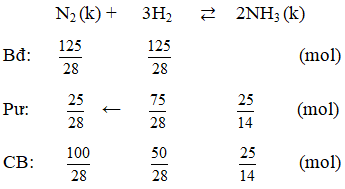
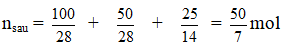
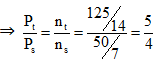



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

