20 bài tập trắc nghiệm Tốc độ phản ứng và cân bằng hóa học (có đáp án)
Với 20 bài tập trắc nghiệm Tốc độ phản ứng và cân bằng hóa học có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm bài tập trắc nghiệm Tốc độ phản ứng và cân bằng hóa học.
20 bài tập trắc nghiệm Tốc độ phản ứng và cân bằng hóa học (có đáp án)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Câu 1: Phát biểu nào sau đây đúng?
A. Khi đốt củi, nếu thêm một ít dầu hỏa, lửa sẽ cháy mạnh hơn. Như vậy dầu hỏa là chất xúc tác cho quá trình này.
B. Trong quá trình sản xuất rượu (ancol) từ gạo người ta rắc men lên gạo đã nấu chín (cơm) trước khi đem ủ vì men là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu.
C. Một chất xúc tác có thể xúc tác cho tất cả các phản ứng.
D. Có thể dùng chất xúc tác để làm giảm tốc độ của phản ứng.
Lời giải:
Đáp án B
Câu 2: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
A. Đốt trong lò kín.
B. Xếp củi chặt khít.
C. Thổi hơi nước.
D. Thổi không khí khô.
Lời giải:
Đáp án D
Câu 3: Tốc độ phản ứng của chất khí sẽ giảm khi:
A. Tăng nồng độ chất tham gia
B. Giảm áp suất của chất khí
C. Tăng nhiệt độ
D. Thêm chất xúc tác.
Lời giải:
Đáp án B
Câu 4: Tốc độ phản ứng cho biết:
A. Độ biến thiên nồng độ các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian
B. Mức độ xảy ra nhanh hay chậm của phản ứng hóa học
C. Ảnh hưởng của nhiệt độ, áp suất đến phản ứng hóa học
D. Tổng số độ biến thiên nhanh hay chậm của phản ứng hóa học.
Lời giải:
Đáp án A
Câu 5: Đối với phản ứng phân hủy H2O2 trong nước, khi thay đổi yếu tố nào sau đây, tốc độ phản ứng không thay đổi?
A. Thêm MnO2
B. Tăng nồng độ H2O2
C. Đun nóng
D. Tăng áp suất H2
Lời giải:
Đáp án D
Câu 6: Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng:
Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
A. 1 B. 2 C. 3 D. 4
Lời giải:
Đáp án D
Câu 7: Cho cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k) ; ΔH< 0
Cho các biện pháp:
Tăng nhiệt độ;
Tăng áp suất chung của hệ phản ứng;
Hạ nhiệt độ;
Dùng thêm chất xúc tác V2O5;
Giảm nồng độ SO3;
Giảm áp suất chung của hệ phản ứng.
Trong các biện pháp trên, những biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Lời giải:
Đáp án B
Câu 8: Cho cân bằng hóa học:
H2 (k) +I2 (k) ⇋ 2HI (k); ΔH > 0
Cân bằng không bị chuyển dịch khi
A. Tăng nhiệt độ của hệ
B. Giảm nống độ HI
C. Tăng nồng độ H2
D. Giảm áp suất chung của hệ.
Lời giải:
Khi hệ cân bằng có số mol khí ở 2 vế bằng nhau thì việc tăng, giảm áp suất không làm cho cân bằng chuyển dịch.
Đáp án D
Câu 9: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu nào sau đây đúng khi nói về cân bằng hóa học này?
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Lời giải:
Đáp án D
Câu 10: Cho cân bằng hóa học sau trong bình kín:
2NO2 (k) ⇋ N2O4 (k)
(màu nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ΔH > 0, phản ứng tỏa nhiệt
B. ΔH < 0, phản ứng tỏa nhiệt
C. ΔH > 0, phản ứng thu nhiệt
D. ΔH < 0, phản ứng thu nhiệt
Lời giải:
Đáp án B
Câu 11: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu nào sau đây đúng?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
Lời giải:
Đáp án B
Câu 12: Cho cân bằng hóa học:
N2 (k) + 3H2 ⇋ 2NH3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi
A. Thay đổi áp suất của hệ
B. Thay đổi nồng độ N2
C. Thay đổi nhiệt độ
D. Thêm chất xúc tác Fe
Lời giải:
Đáp án D
Câu 13: Cho các cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k)
N2 (k) + 3H2 ⇋ 2NH3 (k)
CO2 (k) + H2 (k) ⇋ CO (k) + H2O (k)
2HI (k) ⇋ H2 (k) + I2 (k)
Khi thay đổi áp suất, các cân bằng hóa học đều không bị chuyển dịch là
A. (1) và (3)
B. (2) và (4)
C. (1) và (2)
D. (3) và (4)
Lời giải:
Đáp án D
Câu 14: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4mol/(l.s)
B. 5,0.10-4mol/(l.s)
C. 1,0.10-3mol/(l.s)
D. 5,0.10-4mol/(l.s)
Lời giải:

Đáp án D
Câu 15: Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol. Sau 20 giây phản ứng, nồng độ của chất đó là 0,020 mol. Hãy tính tốc độ trung bình của phản ứng này trong thời gian đã cho.
Lời giải:
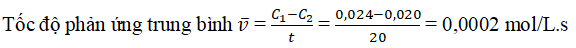
Câu 16. Nồng độ ban đầu của A2 và B2 là 0,03 mol/l. Khi phản ứng:
A2(k) + B2(k) ⇋ 2AB(k);
Khi đạt trạng thái cân bằng, nồng độ của AB là 0,04 mol/l. Hằng số cân bằng của phản ứng trên là:
A. 9 B. 16 C. 32 D. 64
Lời giải:
A2 (k) + B2 (k) ⇋ 2AB (k)
0,02 0,02 0,04
K = 0,042/ (0,01.0,01) = 16
Đáp án B
Câu 17. Cho cân bằng hóa học sau:
CaCO3 (r) ⇋ CaO(r) + CO2 (k); ΔH > 0
Cân bằng sẽ dịch chuyển theo chiều nghịch khi:
A. Tăng áp suất C. Liên tục đẩy CO2 ra khỏi lò
B. Tăng nhiệt độ D. Thêm chất xúc tác
Lời giải:
Đáp án A
Câu 18. Trong một phản ứng thuận nghịch, ở trạng thái cân bằng thì:
A. Các phản ứng thuận và nghịch đều dừng lại
B. Nồng độ các chất trong hệ có giá trị cao nhất
C. Tốc độ của phản ứng thuận và nghịch gần bằng nhau
D. Nồng độ các chất trong hệ không thay đổi, được gọi là nồng độ cân bằng.
Lời giải:
Nồng động các chất ở trạng thái cân bằng không thay đổi
Đáp án D
Câu 19. Cho phản ứng hóa học sau: 2X2 (khí) + Y2 (khí) → 2X2Y
Khi tăng nồng độ của X2 lên 2 lần đồng thời giảm nồng độ của Y2 xuống 4 lần thì tốc độ phản ứng:
A. Giảm 2 lần B. Tăng 4 lần C. Không đổi D. 8 lần
Lời giải:
Đáp án C
Câu 20. Tốc độ phản ứng cho biết:
A. Độ biến thiên nồng độ các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian
B. Mức độ xảy ra nhanh hay chậm của phản ứng hóa học
C. Ảnh hưởng của nhiệt độ, áp suất đến phản ứng hóa học
D. Tổng số độ biến thiên nhanh hay chậm của phản ứng hóa học.
Lời giải:
Đáp án A
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
Dạng 1: Bài tập Lý thuyết về tốc độ phản ứng và cân bằng hóa học
- 25 câu trắc nghiệm Tốc độ phản ứng và cân bằng hóa học có lời giải (cơ bản)
- 25 câu trắc nghiệm Tốc độ phản ứng và cân bằng hóa học có lời giải (nâng cao)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

