Giải thích sự tạo thành liên kết cộng hóa trị. Viết công thức Lewis lớp 10 (cách giải + bài tập)
Chuyên đề phương pháp giải bài tập Giải thích sự tạo thành liên kết cộng hóa trị. Viết công thức Lewis lớp 10 chương trình sách mới hay, chi tiết với bài tập tự luyện đa dạng giúp học sinh ôn tập, biết cách làm bài tập Giải thích sự tạo thành liên kết cộng hóa trị. Viết công thức Lewis.
Giải thích sự tạo thành liên kết cộng hóa trị. Viết công thức Lewis lớp 10 (cách giải + bài tập)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
I. Kiến thức cần nắm vững
1. Liên kết cộng hóa trị
a) Khái niệm
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Cặp electron dùng chung giữa hai nguyên tử có thể được tạo thành theo hai kiểu khác nhau:
- Mỗi nguyên tử góp một hay nhiều electron để tạo thành các cặp electron dùng chung:
Ví dụ:
Liên kết giữa H và Cl còn được biểu diễn bằng 1 gạch nối “ – ”
- Cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa hai nguyên tử là liên kết cộng hóa trị kiểu cho – nhận.
Ví dụ: Khi cặp electron dùng chung chỉ do nguyên tử B đóng góp, nguyên tử B là nguyên tử cho electron, nguyên tử A là nguyên tử nhận electron. Kí hiệu B A.
Nhận xét:
+ Liên kết do sự dùng chung cặp electron là loại liên kết rất phổ biến, thường gặp giữa phi kim với phi kim.
+ Nguyên tử phi kim có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm. Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp chung một hoặc nhiều electron để tạo thành các cặp electron dùng chung. Các cặp electron dùng chung được tính cho cả hai nguyên tử trong phân tử nên mỗi nguyên tử đều đạt cấu hình bền vững theo quy tắc octet. Cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
b) Sự tạo thành liên kết cộng hóa trị
- Cách viết công thức Lewis
Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phân tử. Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “ – ”.
- Sự tạo thành phân tử có liên kết đơn
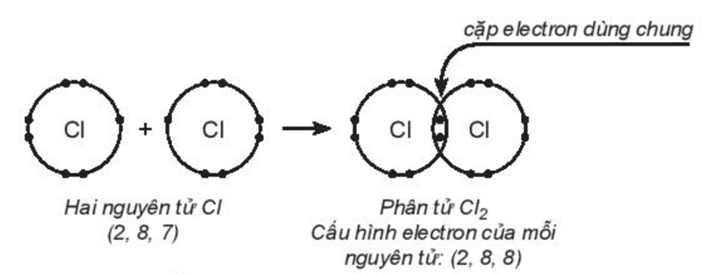
Ví dụ: Sự hình thành liên kết trong phân tử chlorine (Cl2).
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5 (có 7 ở lớp ngoài cùng).
Để đạt cấu hình của khí hiếm gần nhất, nguyên tử Cl cần thêm 1 electron. Vì vậy, hai nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron, tạo thành 1 cặp electron dùng chung. Khi đó, trong phân tử Cl2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet:
Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis:
Chú ý:
Giữa hai nguyên tử chlorine có một cặp electron dùng chung (biểu diễn bằng một gạch nối), đó là liên kết đơn (–).
- Sự tạo thành phân tử có liên kết đôi
Ví dụ: Sự hình thành liên kết trong phân tử oxygen (O2).
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4 (có 6 electron ở lớp ngoài cùng).
Mỗi nguyên tử oxygen có 6 electron hóa trị, hai nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành 2 cặp electron dùng chung. Trong phân tử O2, mỗi nguyên tử oxygen đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Chú ý: Giữa hai nguyên tử oxygen có hai cặp electron dùng chung (biểu diễn bằng hai gạch nối), đó là liên kết đôi (=).
- Sự tạo thành phân tử có liên kết ba
Ví dụ: Sự hình thành liên kết trong phân tử nitrogen (N2).
Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3 (có 5 electron ở lớp ngoài cùng).
Nguyên tử nitrogen có 5 electron hóa trị, hai nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử N2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Chú ý: Giữa hai nguyên tử nitrogen có ba cặp electron dùng chung (biểu diễn bằng ba gạch nối), đó là liên kết ba (º).
Nhận xét:
Liên kết cộng hóa trị trong đó cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực. Ví dụ: Cl2, N2.
Liên kết cộng hóa trị trong đó cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị phân cực. Ví dụ: HCl (cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn là Cl).
2. Liên kết cho – nhận
Liên kết cho – nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
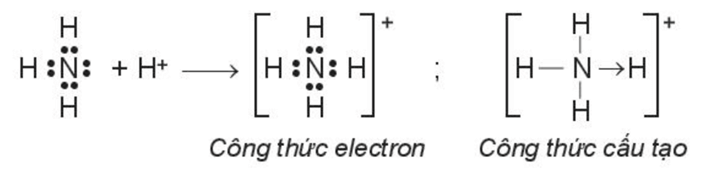
Ví dụ: Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium ().
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành . Khi đó, liên kết cho – nhận được hình thành, nguyên tử nitrogen là nguyên tử cho, ion H+ là nguyên tử nhận.Trong ion , bốn liên kết N – H hoàn toàn tương đương nhau.
Để chỉ rõ sự khác biệt về nguồn gốc cặp electron chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên () xuất phát từ N. Loại liên kết này được gọi là liên kết cho – nhận.
II. Ví dụ minh họa
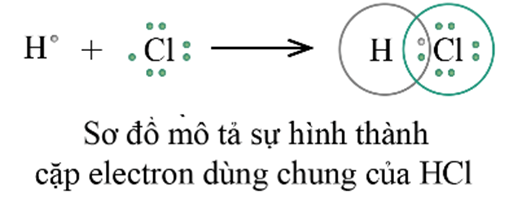
Ví dụ 1: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử hydrogen chloride (HCl).
Hướng dẫn giải
Nguyên tử hydrogen (H) có cấu hình electron 1s1, chlorine (Cl) có cấu hình electron [Ne]3s23p5.
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử chlorine có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Nhận xét: Liên kết trong phân tử HCl có cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl) được gọi là liên kết cộng hóa trị phân cực.
Ví dụ 2: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide (CO2).
Hướng dẫn giải
Cấu hình electron của nguyên tử C (Z = 6): 1s22s22p2 (có 4 electron hóa trị).
Cấu hình electron của nguyên tử O (Z = 8): 1s22s22p4 (có 6 electron hóa trị).
Hai nguyên tử oxygen liên kết với một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron tạo thành 4 cặp electron dùng chung. Khi đó, trong phân tử CO2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
Nhận xét:
Phân tử CO2 có hai liên kết đôi.
Liên kết giữa C và O là liên kết cộng hóa trị phân cực. Tuy nhiên, do phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết (C=O) triệt tiêu nhau, dẫn đến toàn bộ phân tử không bị phân cực.
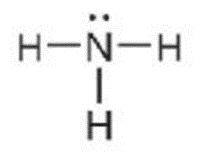
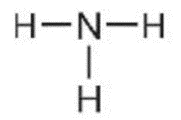
Ví dụ 3: Viết công thức electron, công thức cấu tạo và công thức Lewis của phân tử NH3.
Hướng dẫn giải
Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3.
Cấu hình electron của nguyên tử H (Z = 1): 1s1.
Ba nguyên tử H liên kết với một nguyên tử N bằng cách mỗi nguyên tử H đóng góp 1 electron và nguyên tử N đóng góp 3 electron tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử NH3, mỗi nguyên tử H có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử N có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
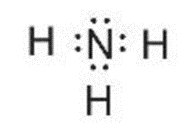 |
 |
 |
Công thức electron |
Công thức Lewis |
Công thức cấu tạo |
III. Bài tập vận dụng
Câu 1. Liên kết cộng hóa trị là liên kết được hình thành bởi
A. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
B. một hay nhiều cặp electron chung giữa hai nguyên tử.
C. một hay nhiều cặp electron chung, trong đó cặp electron chung được đóng góp từ một nguyên tử.
D. một hay nhiều nguyên tử hydrogen với một nguyên tử có độ âm điện lớn.
Câu 2. Liên kết cộng hóa trị thường gặp giữa
A. phi kim và phi kim.
B. kim loại và kim loại.
C. kim loại và phi kim.
D. phi kim và khí hiếm.
Câu 3. Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hóa trị, trong đó
A. cặp electron chung chỉ do một nguyên tử đóng góp.
B. cặp electron chung do hai nguyên tử đóng góp.
C. cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
D. cặp electron chung không bị lệch về phía nguyên tử nào.
Câu 4. Trong hợp chất cộng hóa trị, nếu giữa hai nguyên tử có hai cặp electron chung thì
A. hai cặp electron này được biểu diễn bằng một nối đơn (-) và gọi là liên kết đơn.
B. hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
C. hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đơn.
D. hai cặp electron này được biểu diễn bằng một nối ba (º) và gọi là liên kết ba.
Câu 5. Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị, trong đó
A. cặp electron chung chỉ do một nguyên tử đóng góp.
B. cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn.
C. cặp electron dùng chung lệch về phía nguyên tử có độ âm điện nhỏ hơn.
D. cặp electron dùng chung không bị hút lệch về phía nguyên tử nào.
Câu 6. Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó
A. mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “ – ”.
B. mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “ = ”.
C. mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “ º ”.
D. mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng mũi tên “ ”.
Câu 7. Cho các phân tử sau: NaCl, HCl, O2, N2, NH3, CO2, MgO. Có bao nhiêu phân tử có liên kết cộng hóa trị?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 8. Liên kết hóa học trong phân tử nào sau đây là liên kết cộng hóa trị có cực?
A. O2.
B. HCl.
C. N2.
D. Cl2.
Câu 9. Công thức cấu tạo của N2 là
A. N-N.
B. N=N.
C. NºN.
D. NN.
Câu 10. Liên kết giữa 2 nguyên tử O trong phân tử O2 là
A. liên kết đơn.
B. liên kết đôi.
C. liên kết ba.
D. liên kết cho – nhận.
Câu 11. Trong phân tử hoặc ion nào sau đây chứa liên kết cho – nhận?
A. CO2.
B. MgO.
C. Cl2.
D. H3O+.
Câu 12. Phát biểu nào sau đây không đúng?
A. Phân tử CO2 có công thức cấu tạo là O=C=O.
B. Liên kết hóa học trong phân tử CO2 là liên kết cộng hóa trị phân cực.
C. Phân tử CO2 có hai liên kết đôi.
D. Phân tử CO2 là phân tử phân cực vì chứa liên kết cộng hóa trị phân cực.
Câu 13. Liên kết giữa nguyên tử H và F trong phân tử HF được tạo nên bởi
A. 1 cặp electron chung.
B. 2 cặp electron chung.
C. 3 cặp electron chung.
D. 4 cặp electron chung.
Câu 14. Trong phân tử chlorine (Cl2), hai nguyên tử chlorine liên kết với nhau bằng cách
A. mỗi nguyên tử chlorine góp 1 electron.
B. mỗi nguyên tử chlorine góp 2 electron.
C. mỗi nguyên tử chlorine góp 3 electron.
D. một nguyên tử chlorine nhận 1 electron, một nguyên tử chlorine nhường 1 electron.
Câu 15. Chọn phát biểu đúng.
A. Trong phân tử SO2 có liên kết cho – nhận.
B. Liên kết trong phân tử NaCl là liên kết cho – nhận.
C. Liên kết trong phân tử O2 là liên kết cộng hóa trị có cực.
D. Phân tử N2 có liên kết đôi.
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học 10 hay, chi tiết khác:
- Phân loại liên kết dựa vào hiệu độ âm điện
- Bài tập về sự hình thành liên kết sigma, liên kết pi
- Ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi các chất
- Trắc nghiệm lí thuyết Phản ứng oxi hóa – khử
- Bài tập xác định số oxi hóa của các nguyên tố hóa học
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều









 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

