70 câu trắc nghiệm Cacbon, Silic có lời giải (cơ bản - phần 1)
Với 70 câu trắc nghiệm Cacbon, Silic (cơ bản - phần 1) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Cacbon, Silic (cơ bản - phần 1).
70 câu trắc nghiệm Cacbon, Silic có lời giải (cơ bản - phần 1)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài 1:Trong các phản ứng hóa học sau, phản ứng nào sai?
A. 3CO + Fe2O3
B. CO + Cl2
C. 3CO + Al2O3
D. 2CO + O2
Lời giải:
Đáp án C
CO chỉ khử được các oxit kim loại sau nhôm thành kim loại và CO2 Do đó CO không khử được Al2O3
Bài 2:Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hóa học nào sau đây?
A. CaCO3 + CO2 + H2O → Ca(HCO3)2
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
C. CaCO3 CaO+ CO2
D. Ca(HCO3)2 CaCO3 + CO2 + H2O
Lời giải:
Đáp án D
Phản ứng Ca(HCO3)2 CaCO3 + CO2 + H2O giải thích sự tạo thành thạch nhũ trong các hang động đá vôi, cặn trong ấm đun nước,..
Phản ứng CaCO3 + CO2 + H2O → Ca(HCO3)2 giải thích sự xâm thực đá vôi của nước mưa.
Bài 3:CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
A. đám cháy do xăng dầu
B. đám cháy nhà cửa, quần áo
C. đám cháy do magie hoặc nhôm
D. đám cháy do khí gas
Lời giải:
Đáp án C
Các kim loại mạnh như Mg, Al,... có thể cháy trong khí CO2
2Mg + CO2 → 2MgO + C
Do đó không dùng CO2 để dập tắt đám cháy magie hoặc nhôm
Bài 4:Khí CO2 điều chế trong phòng thí nghiệm thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp ta dùng:
A. dung dịch NaOH đặc
B. dung dịch NaHCO3 bão hòa và dung dịch H2SO4 đặc
C. dung dịch H2SO4 đặc
D. dung dịch Na2CO3 bão hòa và dung dịch H2SO4 đặc
Lời giải:
Đáp án B
Khi cho khí CO2 có lẫn khí HCl và hơi nước qua dung dịch NaHCO3 bão hòa thì HCl sẽ tác dụng với NaHCO3 theo phương trình:
NaHCO3 + HCl → NaCl + CO2 + H2O
Sau đó hơi nước sẽ bị hấp thụ bởi H2SO4 đặc
Loại A và D vì CO2 tác dụng được với Na2CO3 bão hòa và NaOH
Loại C vì không loại bỏ được HCl
Bài 5:Dẫn luồng khí CO dư qua ống sứ nung nóng đựng hỗn hợp Al2O3, CuO, MgO và Fe2O3. Sau khi phản ứng xảy ra hoàn toàn, hỗn hợp rắn còn lại trong ống sứ gồm những chất nào?
A. Al, Cu, Mg, Fe
B. Al2O3, Cu, MgO, Fe
C. Al2O3, Cu, Mg, Fe
D. Al, Cu, MgO, Fe
Lời giải:
Đáp án B
Khí CO khử được oxit kim loại sau nhôm
CO + CuO
3CO + Fe2O3
Vậy hỗn hợp rắn còn lại trong ống sứ gồm Al2O3, Cu, Fe, MgO
Bài 6:Tính oxi hóa của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
A. C + 2H2 → CH4
B. C + 4 HNO3
C. 4C + Fe3O4
D. C + CO2
Lời giải:
Đáp án A
Ở đáp án A, số oxi hóa của C giảm từ 0 xuống -4 → C là chất oxi hóa
Ở đáp án B, số oxi hóa của C tăng từ 0 lên +4 → C là chất khử
Ở đáp án C, số oxi hóa của C tăng từ 0 lên +4 → C là chất khử
Ở đáp án D, số oxi hóa của C tăng từ 0 lên +2 → C là chất khử
Bài 7:Có 4 chất rắn: NaCl, Na2CO3, CaCO3 và BaSO4. Chỉ dùng thêm một cặp chất nào sau đây để nhận biết?
A. H2O và CO2
B. H2O và NaOH
C. H2O và AgNO3
D. H2O và BaCl2
Lời giải:
Đáp án A
Hòa tan 4 chất rắn trên vào nước.
-Chất nào tan trong nước là NaCl, Na2CO3 (nhóm I)
-Chất không tan trong nước là CaCO3, BaSO4 (nhóm II)
Sục khí CO2 vào 2 chất ở nhóm II
-Chất nào tan thu được dung dịch trong suốt thì đó là CaCO3
CaCO3 + CO2 + H2O → Ca(HCO3)2
-Chất không tan là BaSO4
Lấy dung dịch Ca(HCO3)2 thu được ở trên cho vào 2 chất ở nhóm I
-Chất nào xuất hiện làm xuất hiện kết tủa trắng thì đó là Na2CO3
Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
-Chất nào không có hiện tượng gì là NaCl
Bài 8:Trong các phản ứng sau, phản ứng nào cacbon đóng vai trò vừa là chất khử vừa là chất oxi hóa?
A. C + HNO3 đặc nóng →
B. C + H2SO4 đặc nóng →
C. CaO + C 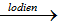
D. C + O2 → CO2
Lời giải:
Đáp án C
A. C + 4HNO3 đặc nóng → CO2 + 4NO2 + 2H2O
→ Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
B. C +2 H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
→ Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
C. CaO + 3C 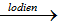
→ Số oxi hóa của C tăng từ 0 lên +2 (trong CO) và giảm từ 0 xuống -1(trong CaC2) nên C vừa là chất khử vừa là chất oxi hóa.
D. C + O2 → CO2
→ Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
Bài 9:Cho cacbon (C) lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, KClO3, CO2, H2SO4 đặc ở điều kiện thích hợp. Số phản ứng mà trong đó C đóng vai trò là chất khử?
A. 6
B. 5
C. 7
D. 4
Lời giải:
Đáp án A
3C + 4Al
C+ H2O
C+ CuO
C + 4HNO3 đặc nóng → CO2 + 4NO2 + 2H2O (4)
3C + 2KClO3
C+ CO2
C +2 H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O (7)
Các phản ứng trong đó C là chất khử là (2), (3), (4), (5), (6), (7) tức là có 6 phản ứng
Bài 10: Cho các chất sau: CO, CO2, SO2, NO, NO2, Cl2, SiO2, H2S, NH3. Lần lượt dẫn chúng qua dung dịch Ba(OH)2 thì xảy ra bao nhiêu phản ứng và bao nhiêu phản ứng oxi hóa khử?
A. 5 phản ứng và 2 phản ứng oxi hóa khử
B. 6 phản ứng và 3 phản ứng oxi hóa khử
C. 4 phản ứng và không có phản ứng oxi hóa khử
D. 6 phản ứng và 2 phản ứng oxi hóa khử
Lời giải:
Đáp án A
Các phản ứng xảy ra là:
CO2 + Ba(OH)2 → BaCO3 + H2O (1)
SO2 + Ba(OH)2 → BaSO3 + H2O (2)
4NO2 +2 Ba(OH)2 → Ba(NO3)2 + Ba(NO2)2+ 2H2O (3)
2Cl2 +2 Ba(OH)2 → BaCl2 + Ba(ClO)2 + 2H2O (4)
H2S+ Ba(OH)2 → BaS + 2H2O (5)
Có 5 phản ứng xảy ra, trong đó phản ứng 3 và 4 là phản ứng oxi hóa khử
Chú ý SiO2 chỉ tan trong kiềm đặc nóng.
Bài 11: Cho một luồng khí CO2 đi qua 30 gam C nung nóng. Khối lượng C còn lại sau phản ứng là 6 gam. Hỗn hợp CO và CO2 thu được có thể tích bằng 112 lít (đktc). Thể tích của khí CO2 dùng ban đầu là:
A. 22,4 lít
B. 44,8 lít
C. 67,2 lít
D. 112 lít
Lời giải:
Đáp án C
Khối lượng C đã phản ứng là 30-6 =24 gam → nC= 2 mol
C+ CO2
2 2 4 mol
→ Sau phản ứng VCO2= 112- 4.22,4= 22,4 lít
→ Thể tích khí CO2 dùng ban đầu là 22,4 + 2.22,4= 67,2 lít
Bài 12: Silic đioxit không tan được trong dung dịch nào sau đây?
A. dd NaOH đặc nóng
B. dd HF
C. dd HCl
D. Na2CO3 nóng chảy
Lời giải:
Đáp án C
Silic đioxit không tan được trong dung dịch HCl
SiO2 + 2NaOH đặc nóng → Na2SiO3 + H2O
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
Bài 13:Silic phản ứng với dãy chất nào sau đây:
A. CuSO4, SiO2, H2SO4 loãng
B. F2, Mg, NaOH
C. HCl, Fe(NO3)3, CH3COOH
D. Na2SiO3, Na3PO4, NaCl
Lời giải:
Đáp án B
Si + 2F2 → SiF4
Si + 2Mg → Mg2Si
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Bài 14: Dãy chuyển hóa nào sau đây đúng với tính chất hóa học của Si và hợp chất của Si?
A. SiO2 → Na2SiO3 → H2SiO3 → SiO2 → Si
B. SiO2 → Na2SiO3 → H2SiO3 → SiO2 → NaHSiO3
C. Si → NaHSiO3 → H2SiO3 → SiO2 → Si
D. Si → SiH4 → SiO2 → NaHSiO3 → SiO2
Lời giải:
Đáp án A
Các PTHH:
SiO2 +2 NaOH nóng chảy/ → Na2SiO3 + H2O
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
H2SiO3
SiO2 + 2Mg → 2MgO + Si
Bài 15:Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH dư, khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm :
A. Mg, Fe, Cu
B. MgO, Fe3O4, Cu
C. MgO, Fe, Cu
D. Mg, Al, Fe, Cu
Lời giải:
Đáp án C
Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thì CO chỉ khử các oxit kim loại sau nhôm:
4CO + Fe3O4
CO + CuO
Chất rắn Y có chứa Al2O3, MgO, Fe, Cu
Cho chất rắn Y vào dung dịch NaOH dư thì:
Al2O3 + 2NaOH → 2 NaAlO2 + H2O
Phần không tan Z là MgO, Fe và Cu.
Bài 16:Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3, nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO trong hỗn hợp đầu là :
A. 0,8 gam
B. 8,3 gam
C. 2,0 gam
D. 4,0 gam
Lời giải:
Đáp án D
Gọi số mol CuO là x, Al2O3 là y mol
Ta có
CuO + CO
x mol x mol
Al2O3 + CO
Ta có: 80x +102y= 9,1
mchất rắn sau pứ= mCu + mAl2O3= 64x+ 102 y=8,3 gam
Giải hệ trên ta có x= 0,05;y= 0,05 → mCuO= 4 gam
Bài 17:Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là :
A. 0,112
B. 0,560
C. 0,224
D. 0,448
Lời giải:
Đáp án D
Bản chất phản ứng:
CO + Ooxit → CO2
H2 + OOxit → H2O
Khối lượng chất rắn giảm chính là khối lượng oxi trong oxit kim loại bị tách ra
Ta có: moxi(oxit)= mchất rắn giảm= 0,32 gam → nO= 0,02 mol
Theo PTHH: nCO, H2= nO(oxit)= 0,02 mol → V= 0,448 lít
Bài 18:Dẫn từ từ V lít khí CO (đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là :
A. 1,12
B. 0,896
C. 0,448
D. 0,224
Lời giải:
Đáp án B
Bản chất phản ứng:
CO + Ooxit → CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Theo PTHH: nCO= nCO2= nCaCO3= 4/100 = 0,04mol → V= 0,896 lít
Bài 19:Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 0,84 gam Fe và 0,02 mol khí CO2. Oxit sắt X và giá trị của V lần lượt là :
A. Fe3O4và 0,224
B. Fe3O4và 0,448
C. FeO và 0,224
D. Fe2O3 và 0,448
Lời giải:
Đáp án B
Đặt công thức oxit sắt là FexOy
FexOy + yCO → xFe + yCO2
nFe= 0,84/56= 0,015 mol
Ta có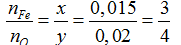
Ta có: nCO= nCO2= 0,02 mol → V= 0,02.22,4= 0,448 lít
Bài 20:Để khử hoàn toàn 45 gam hỗn hợp X gồm CuO, FeO, Fe3O4, Fe2O3 và MgO cần dùng vừa đủ 8,4 lít khí CO (đktc). Khối lượng chất rắn Y thu được sau phản ứng là:
A. 39 gam
B. 51 gam
C. 24 gam
D. 42 gam
Lời giải:
Đáp án A
Bản chất phản ứng : CO + Ooxit → CO2
Theo PTHH: nO(oxit)= nCO= 8,4/22,4= 0,375 mol
Ta có khối lượng chất rắn giảm chính là khối lượng oxi trong oxit tách ra
Khối lượng chất rắn Y thu được sau phản ứng là:
45 - 0,375.16= 39 gam
Bài 21:Cho khí CO đi qua m gam Fe2O3 nung nóng thì thu được 10,68 gam chất rắn X và khí Y. Cho toàn bộ khí Y hấp thụ vào dung dịch Ca(OH)2 dư thì thấy tạo ra 3 gam kết tủa. Giá trị của m là:
A. 11,16
B. 11,58
C. 12,0
D. 12,2
Lời giải:
Đáp án A
Bản chất phản ứng:
CO + Ooxit → CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Theo PTHH: nO (oxit)= nCO2= nCaCO3= 3/100 = 0,03 mol
→ m= mchất rắn X + mO (oxit tách)= 10,68 + 0,03.16= 11,16 gam
Bài 22:Cho khí CO đi qua ống sứ chứa 16 gam Fe2O3 đun nóng, sau phản ứng thu được hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3. Hòa tan hoàn toàn X bằng H2SO4 đặc, nóng bằng dung dịch Y. Cô cạn dung dịch Y, khối lượng muối khan thu được bằng:
A. 20 gam
B. 32 gam
C. 40 gam
D. 48 gam
Lời giải:
Đáp án C
Ta có sơ đồ phản ứng
CO + Fe2O3 → Fe, FeO, Fe3O4, Fe2O3 + H2SO4 đặc → Fe2(SO4)3
Bảo toàn nguyên tố Fe ta có: nFe2(SO4)3= nFe2O3= 16/160 = 0,1 mol
→ mFe2(SO4)3= 0,1.400= 40 gam
Bài 23:Dẫn từ từ 4,48 lít khí CO2(đktc) vào 500 ml dung dịch NaOH 1M thu được dung dịch Y. Thành phần chất tan trong dung dịch Y là:
A. NaOH, Na2CO3
B. Na2CO3
C. NaOH, NaHCO3
D. NaHCO3, Na2CO3
Lời giải:
Đáp án A
Ta có: nCO2= 4,48/22,4= 0,2 mol; nNaOH= 0,5.1= 0,5 mol
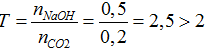
2NaOH + CO2 → Na2CO3 + H2O
Bài 24:Xác định khối lượng kết tủa thu được khi dẫn từ từ 6,72 lít khí CO2(đktc) vào 400 ml dung dịch Ca(OH)2 1M?
A. 30 gam
B. 40 gam
C. 35 gam
D. 45 gam
Lời giải:
Đáp án A
nCO2= 6,72/22,4= 0,3 mol; nCa(OH)2= 0,4.1= 0,4 mol
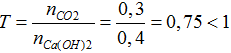
CO2 + Ca(OH)2 → CaCO3 + H2O
Ta có: 0,3 <0,4 nên CO2phản ứng hết, Ca(OH)2 còn dư
Ta có: nCaCO3= nCO2= 0,3 mol → mCaCO3= 0,3.100= 30,0 gam
Bài 25:Cho 2,8 gam CaO tác dụng với lượng nước dư thu được dung dịch A. Sục 1,68 lít khí CO2(đktc) vào dung dịch A thu được m gam kết tủa và dung dịch B. Đun nóng dung dịch B lại thu được m’ gam kết tủa nữa. Giá trị của m và m’ lần lượt là:
A. 2,5 và 2,5
B. 2,5 và 5,0
C. 5,0 và 5,0
D. 2,5 và 7,5
Lời giải:
Đáp án A
CaO+ H2O → Ca(OH)2
Ta có: nCa(OH)2= nCaO= 0,05 mol; nCO2= 1,68/22,4= 0,075 mol
Khi sục khí CO2vào dung dịch A:
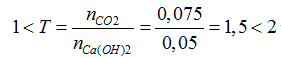
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Ca(HCO3)2
Đặt số mol CaCO3 PT 1 là x mol; số mol Ca(HCO3)2 PT 2 là y mol
Ta có: nCO2= x+2y= 0,075 mol; nCa(OH)2= x+y= 0,05 mol
→ x=y= 0,025 mol → m= mCaCO3= 0,025.100= 2,5 gam
Theo PT (2) và (3): nCaCO3= nCa(HCO3)2= 0,025 mol
→ m'= mCaCO3= 0,025.100= 2,5 gam
Bài 26:Cho 10 lít (đktc) hỗn hợp khí gồm N2 và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l thu được 1 gam kết tủa. Thành phần % theo thể tích N2 trong hỗn hợp ban đầu là:
A. 2,24% hoặc 84,32%
B. 2,24% hoặc 15,68%
C. 15,68% hoặc 97,76%
D. 84,32% hoặc 97,76%
Lời giải:
Đáp án D
Ta có nCa(OH)2= 2.0,02= 0,04 mol; nCaCO3= 1/100= 0,01 mol
Ta có nCa(OH)2 > nCaCO3 nên có 2 trường hợp:
-TH1: Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O(1)
Theo PT (1): nCaCO3= nCO2= 0,01 mol → VCO2=0,01.22,4=0,224 lít
→ %VCO2= 2,24% → %VN2= 100%- 2,24%=97,76%
-TH2: Ca(OH)2 phản ứng hết:
CO2 + Ca(OH)2 → CaCO3 + H2O(1)
0,01 0,01 ← 0,01 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
2.0,03 (0,04-0,01)
Ta có: nCO2= 0,01+ 2.0,03= 0,07 mol → VCO2= 0,07.22,4=1,568 lít
→ %VCO2= 15,68% → %VN2= 100%- 15,68%=84,32%
Bài 27:Hòa tan hoàn toàn 11,2 gam CaO vào nước ta thu được dung dịch A. Nếu cho khí CO2 sục qua dung dịch A và sau khi kết thúc thí nghiệm thấy có 2,5 gam kết tủa thì có bao nhiêu lít CO2 (đktc) đã tham gia phản ứng?
A. 0,56 lit hoặc 8,4 lít
B. 0,56 lit hoặc 5,6 lít
C. 5,6 lít hoặc 2,24 lít
D. 2,24 lít hoặc 5,6 lít
Lời giải:
Đáp án A
CaO+ H2O → Ca(OH)2
Ta có: nCa(OH)2= nCaO= 11,2/56=0,2 mol; nCaCO3= 2,5/100= 0,025mol
Ta có nCa(OH)2 > nCaCO3 nên có 2 trường hợp:
-TH1: Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Theo PT (1): nCaCO3= nCO2= 0,025 mol → VCO2=0,025.22,4=0,56 lít
-TH2: Ca(OH)2 phản ứng hết:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
0,025 0,025 ← 0,025 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
0,35 (0,2-0,025)
Ta có: nCO2= 0,025+ 0,35= 0,375 mol → VCO2= 0,375.22,4=8,4 lít
Bài 28:Sục 1,792 lít khí SO2 (đktc) vào 250 ml dung dịch Ba(OH)2 nồng độ C mol/lít. Phản ứng xảy ra hoàn toàn thu được 8,68 gam kết tủa. Giá trị của C là:
A. 0,16M
B. 0,20M
C. 0,24M
D. 0,12M
Lời giải:
Đáp án C
Ta có: nSO2= 1,792/22,4= 0,08 mol; nBaSO3= 8,68/ 217= 0,04 mol
Ta có: nSO2 > nBaSO3 nên xảy ra 2 PTHH sau:
SO2 + Ba(OH)2 → BaSO3 + H2O (1)
0,04 0,04 ← 0,04 mol
2SO2 + Ba(OH)2 → Ba(HSO3)2 (2)
(0,08-0,04) → 0,02 mol
Tổng số mol Ba(OH)2 là: nBa(OH)2= 0,04 + 0,02 = 0,06 mol
→ C= CM Ba(OH)2= 0,06/ 0,25= 0,24M
Bài 29:Sục V lít khí CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1M và NaOH 1M. Sau phản ứng thu được 19,7 gam kết tủa. Giá trị lớn nhất của V là:
A. 13,44
B. 17,92
C. 20,16
D. 11,2
Lời giải:
Đáp án D
Ta có:
nBa(OH)2= 0,2.1= 0,2 mol; nNaOH= 0,2.1= 0,2 mol; nBaCO3= 19,7/197= 0,1 mol
nOH-= 0,2.2 + 0,2= 0,6 mol; nBa2+= 0,2 mol
Do đề hỏi giá trị lớn nhất của V nên số mol CO2 phải lớn nhất. Khi đó xảy ra 2 PT sau:
CO2 + 2OH- → CO32-+ H2O (1)
0,1 0,2 ← 0,1 mol
CO2 + OH- → HCO3- (2)
0,4 ← (0,6-0,2)
Ba2++ CO32- → BaCO3 (3)
0,2 0,1 ← 0,1 mol
Theo PT (1), (2) ta có: nCO2= 0,1 + 0,4= 0,5 mol → VCO2= 0,5.22,4= 11,2 lít
Bài 30:Sục 5,6 lít khí CO2 (đktc) vào 200 ml dung dịch hỗn hợp NaOH 1M, Ba(OH)2 0,5M, KOH 0,5M. Kết thúc phản ứng thu được m gam kết tủa. Trị số của m là:
A. 49,25 gam
B. 21,7 gam
C. 54,25 gam
D. 19,7 gam
Lời giải:
Đáp án D
Ta có: nCO2= 5,6/22,4=0,25 mol
nBa(OH)2= 0,2. 0,5= 0,1 mol; nNaOH= 0,2.1= 0,2 mol; nKOH= 0,2.0,5= 0,1 mol
nOH-= 0,1.2 + 0,2 + 0,1= 0,5 mol; nBa2+= 0,1 mol
Ta có: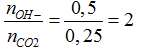
CO2 + 2OH- → CO32-+ H2O (1)
0,25 0,5 0,25 mol
Ba2++ CO32- → BaCO3 (2)
Ta có 0,1 < 0,25 nên Ba2+ phản ứng hết
→ nBaCO3= nBa2+= 0,1 mol → mBaCO3= 0,1.197= 19,7 gam
Bài 31:Một loại thủy tinh có thành phần phần trăm về khối lượng: SiO2 50,42%; CaO 23,53%; Na2O 26,05%. Trong loại thủy tinh này 1,0 mol Na2O kết hợp với:
A. 2,0 mol SiO2 và 1,0 mol CaO
B. 1,0 mol SiO2 và 2,0 mol CaO
C. 1,0 mol SiO2 và 1,0 mol CaO
D. 2,0 mol SiO2 và 2,0 mol CaO
Lời giải:
Đáp án A
Đặt công thức của thủy tinh là (Na2O)x. (CaO)y.(SiO2)z
Ta có: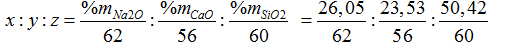
= 0,42: 0,42: 0,84= 1:1:2 → Công thức của thủy tinh là Na2O. CaO.2SiO2
→ 1 mol Na2O kết hợp với 1 mol CaO và 2 mol SiO2
Bài 32:Loại thủy tinh khó nóng chảy chứa 18,43% K2O; 10,98% CaO và 70,59% SiO2 có công thức dưới dạng các oxit là:
A. K2O. CaO.4SiO2
B. K2O. 2CaO.6SiO2
C. K2O. CaO.6SiO2
D. K2O. 3CaO.8SiO2
Lời giải:
Đáp án C
Đặt công thức của thủy tinh là (K2O)x. (CaO)y.(SiO2)z
Ta có: 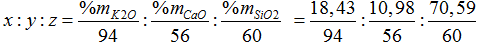
= 0,196: 0,196: 1,1765= 1:1:6 → Công thức của thủy tinh là Na2O. CaO.6SiO2
Bài 33:Thành phần chính của đất sét là cao lanh, có công thức là x Al2O3.ySiO2.zH2O, trong đó tỉ lệ về khối lượng các oxit và nước tương ứng là 0,3696;0,4348; 0,1957. Công thức hóa học nào dưới đây là của cao lanh đã cho?
A. Al2O3.2SiO2.3H2O
B. Al2O3.3SiO2.2H2O
C. 3Al2O3.SiO2.2H2O
D. 2Al2O3.SiO2.3H2O
Lời giải:
Đáp án A
Ta có:
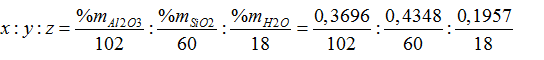
=0,00362:0,0072: 0,01087= 1:2:3
→ Công thức của cao lanh là: Al2O3.2SiO2.3H2O
Bài 34:Khi đốt cháy hỗn hợp X gồm SiH4 và CH4 thu được chất rắn nặng 6 gam và chất khí. Cho chất khí qua dung dịch NaOH dư thu được 31,8 gam muối khan. Thành phần phần trăm theo thể tích của mỗi khí trong A là:
A. 45% và 55%
B. 26% và 74%
C. 30% và 70%
D. 25% và 75%
Lời giải:
Đáp án D
Đốt cháy hỗn hợp gồm SiH4 và CH4 thu được chất rắn là SiO2 và chất khí là CO2.
Ta có: SiH4 +2 O2
CH4 +2 O2
Ta có: nSiH4= nSiO2= 6/60= 0,1 mol
Khi cho khí CO2 qua dung dịch NaOH dư thì:
CO2 + 2NaOH → Na2CO3 + H2O
Theo PTHH: nCH4= nCO2=nNa2CO3= 31,8/106= 0,3 mol
→ nX= nCH4 + nSiH4= 0,3 + 0,1= 0,4 mol
Trong cùng điều kiện, tỉ lệ về số mol chính là tỉ lệ về thể tích
→ 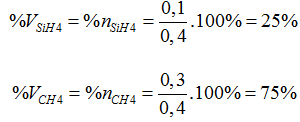
Bài 35:Cho nhận xét sau:
1)Silic vừa thể hiện tính khử vừa thể hiện tính oxi hóa
2)Trong công nghiệp, silic được điều chế bằng cách đốt cháy hỗn hợp gồm bột Mg và cát nghiền mịn
3)SiO2 là một acidic oxide, tan được trong nước tạo ra axit silixic
4)Silic siêu tinh khiết là chất bán dẫn trong kĩ thuật vô tuyến và điện tử
5)Axit silixic có tính axit yếu hơn axit cacboxilic
Số nhận xét đúng là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án C
1) Đúng: Silic có các số oxi hóa là -4; 0; +2; +4. Tuy nhiên số oxi hóa +2 ít phổ biến.
2) Sai: Trong công nghiệp, silic được điều chế bằng cách dùng than cốc khử SiO2 trong lò điện ở nhiệt độ cao.
3) Sai: SiO2 là acidic oxide nhưng không tan trong nước
4) Đúng
5) Đúng. Ví dụ: Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập lý thuyết về tính chất hóa học của Cacbon, Silic
- Dạng 2: Bài tập CO2 tác dụng với dung dịch kiềm
- 70 câu trắc nghiệm Cacbon, Silic có lời giải (cơ bản - phần 2)
- 70 câu trắc nghiệm Cacbon, Silic có lời giải (nâng cao - phần 1)
- 70 câu trắc nghiệm Cacbon, Silic có lời giải (nâng cao - phần 2)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

