Bài tập chuẩn độ acid, base (cách giải + bài tập)
Chuyên đề phương pháp giải bài tập chuẩn độ acid - base lớp 11 chương trình sách mới hay, chi tiết với bài tập tự luyện đa dạng giúp học sinh ôn tập, biết cách làm bài tập chuẩn độ acid - base.
Bài tập chuẩn độ acid, base (cách giải + bài tập)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
A. Lý thuyết và phương pháp giải
Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
+ Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
+ Dùng chất chỉ thị acid – base như (giấy quỳ tím, giấy pH, phenolphthalein,…) để xác định pH ở thời điểm tương đương (thời điểm phản ứng vừa đủ).
- Chuẩn độ dung dịch acid
+ Dung dịch chuẩn đã biết nồng độ là dung dịch base.
+ Cho dung dịch base đã biết nồng độ phản ứng vừa đủ với dung dịch acid (cần chuẩn độ).
- Chuẩn độ dung dịch base
+ Dung dịch chuẩn đã biết nồng độ là dung dịch acid.
+ Cho dung dịch acid đã biết nồng độ phản ứng vừa đủ với dung dịch base (cần chuẩn độ).
Ví dụ:
Trong phòng thí nghiệm, nồng độ của dung dịch base mạnh (NaOH) được xác định bằng một dung dịch acid mạnh (HCl) đã biết trước nồng độ mol dựa trên phản ứng:
NaOH + HCl → NaCl + H2O
Khi các chất phản ứng vừa đủ với nhau, số mol HCl phản ứng bằng số mol NaOH.
Ta có:
VHCl. CHCl = VNaOH. CNaOH
Trong đó:
+ CHCl, CNaOH lần lượt là nồng độ mol của dung dịch HCl và NaOH.
+ VHCl, VNaOH lần lượt là thể tích của dung dịch HCl và NaOH (cùng đơn vị đo).
Khi biết VHCl, VNaOH trong quá trình chuẩn độ và biết CHCl sẽ tính được CNaOH.
B. Ví dụ minh hoạ
Ví dụ 1: Một học sinh thực hiện thí nghiệm sau: Lấy 10 mL dung dịch HCl 0,2 M cho vào 5 mL dung dịch NH3 thu được dung dịch A. Chuẩn độ lượng HCl dư trong dung dịch A bằng dung dịch NaOH 0,1 M thấy phản ứng hết 10,2 mL. Tính nồng độ của dung dịch NH3 ban đầu.
Hướng dẫn giải
Số mol HCl ban đầu = 10.10-3.0,2 = 2.10-3 (mol)
Số mol HCl phản ứng với NH3 = 2.10-3 – 1,02.10-3 = 0,98.10-3 (mol)
Ví dụ 2: Vỏ trứng có chứa calcium ở dạng CaCO3. Để xác định hàm lượng CaCO3 trong vỏ trứng, trong phòng thí nghiệm người ta có thể làm như sau:
Lấy 1,0 g vỏ trứng khô, đã được làm sạch, hòa tan hoàn toàn trong 50 mL dung dịch HCl 0,4 M. Lọc dung dịch sau phản ứng thu được 50 mL dung dịch A. Lấy 10 mL dung dịch A chuẩn độ với dung dịch NaOH 0,1 M thấy hết 5,6 mL. Xác định hàm lượng cacium trong vỏ trứng (giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl).
Hướng dẫn giải
Số mol HCl tác dụng với NaOH là
Số mol HCl có trong 50 mL dung dịch A là:
Số mol HCl phản ứng với CaCO3 là:
C. Bài tập minh hoạ
Câu 1. Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 15 mL dung dịch NaOH. Nồng độ của dung dịch HCl là
A. 0,10M.
B. 0,15M.
C. 0,01M.
D. 0,25M.
Hướng dẫn giải
Đáp án đúng là: B
Phương trình hoá học: NaOH + HCl → NaCl + H2O
Ta có: CHCl.VHCl = CNaOH.VNaOH
Câu 2. Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,02 M. Để chuẩn độ 5 mL dung dịch HCl này cần 10 mL dung dịch NaOH. Nồng độ của dung dịch HCl là
A. 0,01M.
B. 0,05M.
C. 0,02M.
D. 0,04M.
Hướng dẫn giải
Đáp án đúng là: D
NaOH + HCl → NaCl + H2O
Ta có: CHCl.VHCl = CNaOH.VNaOH
Câu 3. Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,1 M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Nồng độ của dung dịch NaOH là
A. 0,10M.
B. 0,15M.
C. 0,12M.
D. 0,14M.
Hướng dẫn giải
Đáp án đúng là: C
NaOH + HCl → NaCl + H2O
Ta có: CHCl.VHCl = CNaOH.VNaOH
Câu 4. Để xác định nồng độ của một dung dịch KOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,01 M. Để chuẩn độ 10 mL dung dịch KOH này cần 16 mL dung dịch HCl. Nồng độ của dung dịch KOH là
A. 0,010M.
B. 0,016M.
C. 0,012M.
D. 0,014M.
Hướng dẫn giải
Đáp án đúng là: B
KOH + HCl → KCl + H2O
Ta có: CHCl.VHCl = CKOH.VKOH
Câu 5. Để xác định nồng độ của một dung dịch H2SO4, người ta đã tiến hành chuẩn độ bằng dung dịch KOH 0,2 M. Để chuẩn độ 10 mL dung dịch H2SO4 này cần 10 mL dung dịch KOH. Nồng độ của dung dịch H2SO4 là
A. 0,10M.
B. 0,15M.
C. 0,12M.
D. 0,14M.
Hướng dẫn giải
Đáp án đúng là: A
2KOH + H2SO4 → K2SO4 + 2H2O
Ta có:
Câu 6. Để xác định nồng độ của một dung dịch HNO3, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,01 M. Để chuẩn độ 10 mL dung dịch HNO3 này cần 20 mL dung dịch NaOH. Nồng độ của dung dịch HNO3 là
A. 0,01M.
B. 0,05M.
C. 0,02M.
D. 0,04M.
Hướng dẫn giải
Đáp án đúng là: C
NaOH + HNO3 → NaNO3 + H2O
Ta có:
Câu 7. Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50,0 mL dung dịch NaOH 0,213 M vào 100 mL dung dịch mẫu A rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion OH-. Phần ion dư này cần 13,21 mL HCl 0,103 M để trung hòa. Nồng độ mol.L-1 của mẫu A là
A. 0,4640.
B. 0,0464.
C. 0,0646.
D. 0,0060.
Hướng dẫn giải
Đáp án đúng là: B
Phương trình hóa học của các phản ứng xảy ra như sau:
2NaOH + H2SO4 → Na2SO4 + 2H2O
HCl + NaOH → NaCl + H2O
Số mol NaOH thêm vào 100 mL dung dịch H2SO4 là: 0,05.0,213 = 1,065.10-2 (mol).
Số mol NaOH được trung hòa bởi HCl là 0,01321.0,013 = 1,361.10-3 (mol).
Số mol NaOH được trung hòa bởi 100mL dung dịch H2SO4 là: 1,065.10-2 – 1,361.10-3 = 9,289.10-3(mol).
Vậy nồng độ H2SO4 trong mẫu phân tích là
Câu 8. Để chuẩn độ 40 mL dung dịch HCl chưa biết nồng độ đã dùng trung bình hết 34 mL dung dịch NaOH 0,12 M. Nồng độ mol của dung dịch HCl là
A. 0,102M.
B. 0,105M.
C. 0,002M.
D. 0,004M.
Hướng dẫn giải
Đáp án đúng là: A
Câu 9. Để chuẩn độ 50 mL dung dịch CH3COOH chưa biết nồng độ đã dùng trung bình hết 75 mL dung dịch NaOH 0,05 M. Nồng độ mol của dung dịch CH3COOH là
A. 0,001M.
B. 0,075M.
C. 0,375M.
D. 0,004M.
Hướng dẫn giải
Đáp án đúng là: B
nNaOH = 0,075. 0,05 = 0,00375 (mol).
CH3COOH + NaOH CH3COONa + H2O
0,00375 0,00375 (mol)
Câu 10. Để xác định nồng độ của một dung dịch HNO3, người ta đã tiến hành chuẩn độ bằng dung dịch KOH 0,01 M. Để chuẩn độ 10 mL dung dịch HNO3 này cần 5 mL dung dịch KOH. Nồng độ của dung dịch HNO3 là
A. 0,001M.
B. 0,005M.
C. 0,002M.
D. 0,004M.
Hướng dẫn giải
Đáp án đúng là: B
NaOH + HNO3 → NaNO3 + H2O
Ta có:
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học 11 hay, chi tiết khác:
- Tính pH của dung dịch sau pha trộn
- Bài tập tổng hợp ammonia (NH3)
- Bài tập về tính oxi hoá của HNO3
- Bài tập về tính acid của H2SO4 loãng
- Bài tập về tính oxi hoá của H2SO4 đặc
- Xác định công thức phân tử của hợp chất hữu cơ
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

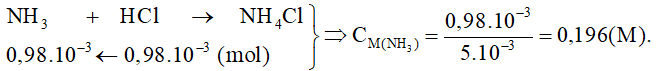



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

