Bài tập hợp chất tác dụng với HNO3 và cách giải
Với Bài tập hợp chất tác dụng với HNO3 và cách giải sẽ giúp học sinh nắm vững lý thuyết, biết cách làm bài tập từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi môn Hóa 11.
Bài tập hợp chất tác dụng với HNO3 và cách giải
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
A. Lý thuyết ngắn gọn
HNO3 đặc oxi hóa được hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
4HNO3 + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
B. Phương pháp giải
Bước 1: Lập sơ đồ phản ứng biểu diễn quá trình chuyển hóa giữa các chất.
Bước 2: Xác định đầy đủ, chính xác chất khử và chất oxi hóa, trạng thái số oxi hóa của chất khử, chất oxi hóa trước và sau phản ứng; không cần quan tâm đến số oxi hóa của chất khử và chất oxi hóa ở các quá trình trung gian nếu phản ứng xảy ra nhiều giai đoạn.
Bước 3: Thiết lập phương trình toán học: Tổng số mol electron chất khử nhường bằng tổng số mol electron mà chất oxi hóa nhận, kết hợp với các giả thiết khác để lập các phương trình toán học khác có liên quan. Giải hệ phương trình để suy ra kết quả mà đề yêu cầu.
Chú ý: Nếu hỗn hợp gồm cả kim loại và oxit kim loại phản ứng với HNO3 (và giả sử tạo ra khí NO) thì nHNO3 = 4nNO + 2nO(trong oxit kim loại)
C. Ví dụ minh họa
Ví dụ 1: Hòa tan hoàn toàn 2,32 gam hỗn hợp FeO và Fe2O3 vào dung dịch HNO3 đặc, dư thì thu được 0,224 lít khí NO2 (đktc). Tính khối lượng muối Fe(NO3)3 tạo thành sau phản ứng
A. 7,26 gam.
B. 7,20 gam.
C. 7,06 gam.
D. 6,02 gam.
Lời giải chi tiết
nNO2 = 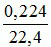 = 0,01mol
= 0,01mol
Trong hỗn hợp chỉ có FeO phản ứng tạo thành chất khí.
Phương trình hóa học:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + H2O
Theo phương trình: nFe = nNO2 = 0,01 mol
→ mFeO = 0,01.72 = 0,72g
→ mFe2O3 = 2,23 - 0,72 = 1,6g
→ nFe2O3 = 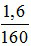 = 0,01 mol
= 0,01 mol
Bảo toàn nguyên tố Fe: nFe(NO3)3 = nFeO + 2nFe2O3 = 0,03 mol
→ mFe2O3 = 0,03 . 242 = 7,26g
Chọn A.
Ví dụ 2: Cho 60 gam hỗn hợp Cu và CuO tan hết trong dung dịch HNO3, thu được 13,44 lít khí NO (đktc). Phần trăm khối lượng của CuO trong hỗn hợp ban đầu là
A. 69%.
B. 96%.
C. 4%.
D. 31%.
Lời giải chi tiết
nNO = 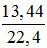 = 0,6 mol
= 0,6 mol
Phương trình hóa học:
3Cu + 8HNO3 → 3Cu(NO3)3 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo phương trình (1): nCu = 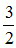 nNO =
nNO = 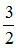 .0,6 = 0,9 mol
.0,6 = 0,9 mol
→ mCu = 0,09.64 = 57,6g
→ %mCu = 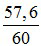 .100% = 96%
.100% = 96%
→ %mCuO = 100% - 96% = 4%
Chọn C.
Ví dụ 3: Hòa tan hết hỗn hợp chứa 10 gam CaCO3 và 17,4 gam FeCO3 bằng dung dịch HNO3 loãng, nóng. Số mol HNO3 đã tham gia phản ứng là
A. 0,8 mol.
B. 0,5 mol.
C. 0,7 mol.
D. 0,2 mol.
Lời giải chi tiết
nCaCO3 = 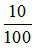 = 0,1 mol; nFeCO3 =
= 0,1 mol; nFeCO3 = 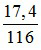 = 0,15 mol
= 0,15 mol
Phương trình hóa học:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
3FeCO3 + 10HNO3 → 3Fe(NO3)3 + NO + 3CO2 + 5H2O
Theo phương trình: nHNO3 = 2nCaCO3 + 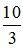 nFeCO3 = 2. 0,1 +
nFeCO3 = 2. 0,1 + 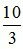 . 0,15 = 0,7 mol
. 0,15 = 0,7 mol
Chọn C.

D. Bài tập tự luyện
Câu 1: Hoà tan hoàn toàn hỗn hợp gồm x mol FeS2 và y mol Cu2S vào axit HNO3 (vừa đủ), thu được dung dịch X (chỉ chứa hai muối sunfat) và khí duy nhất NO. Tỉ lệ x : y là
A. 1:3.
B. 3:1.
C. 1:2.
D. 2:1
Câu 2: Cho 18,5 gam hỗn hợp gồm Fe và Fe3O4 tác dụng với 200 ml dung dịch HNO3 loãng, đun nóng. Sau phản ứng thu được 2,24 lít khí NO duy nhất (đktc), dung dịch D và còn lại 1,46 gam kim loại. Nồng độ mol của dung dịch HNO3 là
A. 3,2M.
B. 3,5M.
C. 2,6M.
D. 5,1M.
Câu 3: Cho hỗn hợp gồm 6,72 gam Mg và 0,8 gam MgO tác dụng hết với lượng dư dung dịch HNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít một khí X (đktc) và dung dịch Y. Làm bay hơi dung dịch Y thu được 46 gam muối khan. Khí X là
A. NO2.
B. N2O.
C. NO.
D. N2.
Câu 4: Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hoàn toàn hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 1,68 lít (đktc) NO2 (là sản phẩm khử duy nhất). Giá trị của m là
A. 2,52 gam.
B. 2,22 gam.
C. 2,62 gam.
D. 2,32 gam.
Câu 5: Để m gam phoi bào sắt ngoài không khí sau một thời gian biến thành hỗn hợp A có khối lượng 12 gam gồm Fe và các oxit FeO, Fe3O4, Fe2O3. Cho B tác dụng hoàn toàn với nitric acid dư thấy giải phóng ra 2,24 lít khí duy nhất NO. Giá trị của m và số mol HNO3 đã phản ứng là
A. 10,08 gam và 0,64 mol.
B. 8,88 gam và 0,54 mol.
C. 10,48 gam và 0,64 mol.
D. 9,28 gam và 0,54 mol.
Câu 6: Đun nóng 28 gam bột sắt trong không khí một thời gian thu được m gam hỗn hợp rắn A gồm FeO, Fe2O3, Fe3O4 và Fe. Hòa tan hết A trong lượng dư dung dịch HNO3 đun nóng, thu được dd B và 2,24 lít khí NO duy nhất (đktc). Giá trị của m là
A. 35,2 gam.
B. 37,6 gam.
C. 56 gam.
D. 40 gam.
Câu 7: Trộn 0,81 gam bột nhôm với bột Fe2O3 và CuO rồi đốt nóng để tiến hành phản ứng nhiệt nhôm thu được hỗn hợp A. Hoà tan hoàn toàn A trong dung dịch HNO3 đun nóng thu được V lít khí NO (sản phẩm khử duy nhất) ở đktc. Giá trị của V là
A. 0,224 lít.
B. 0,672 lít.
C. 2,24 lít.
D. 6,72 lít.
Câu 8: Hòa tan hoàn toàn 30,4 gam chất rắn X gồm Cu, CuS, Cu2S và S bằng dung dịch HNO3 dư, thoát ra 20,16 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm Ba(OH)2 dư vào dung dịch Y thu được m gam kết tủa. Giá trị của m là
A. 81,55.
B. 110,95.
C. 115,85.
D. 14,20.
Câu 9: Cho dung dịch HNO3 loãng tác dụng với m gam hỗn hợp Zn và ZnO tạo ra dung dịch có chứa 8 gam NH4NO3 và 132,3 gam Zn(NO3)2. Giá trị của m bằng
A. 82,7 gam.
B. 50,3 gam.
C. 102,2 gam.
D. 51,1 gam.
Câu 10: Hòa tan hoàn toàn m gam FeCO3 trong dung dịch HNO3 thu được 10,08 lít hỗn hợp 2 khí (ở đktc) có tỉ khối so với H2S bằng 1,294. Giá trị của m bằng:
A. 23,2 gam.
B. 46,4 gam.
C. 34,8 gam.
D. 38,7 gam.
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
D |
C |
D |
A |
A |
B |
D |
B |
B |
B |
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Bài tập xác định chất khử, sản phẩm khử và cách giải
- Bài tập nhiệt phân muối nitrate và cách giải
- Các dạng toán P2O5 tác dụng với dung dịch kiềm và cách giải
- Lý thuyết cacbon và hợp chất cacbon hay nhất
- Lý thuyết Si và hợp chất của Si, công nghiệp silicat hay nhất
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

