Lý thuyết Axit, bazơ, muối (hay, chi tiết nhất)
Bài viết Lý thuyết Axit, bazơ, muối hay, chi tiết giúp bạn nắm vứng kiến thức trọng tâm về Axit, bazơ, muối.
Lý thuyết Axit, bazơ, muối (hay, chi tiết nhất)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Bài 2: Axit, bazơ và muối - Cô Nguyễn Nhàn (Giáo viên VietJack)
1. Axit, bazo, muối
a. Axit và bazơ theo thuyết Areniut
* Axit:Là chất khi tan trong nước phân li cho ion H+.
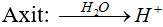
* Bazơ:Là chất khi tan trong nước phân li cho ion OH-.
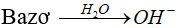
* Axit nhiều nấc:Những axit khi tan trong nước phân li nhiều nấc cho ion H+.
Ví dụ:
H3PO4 → H+ + H2PO4-
H2PO4- → H+ + HPO42-
HPO42- → H+ + PO43-
* Bazơ nhiều nấc:Những bazơ khi tan trong nước phân li nhiều nấc cho ion OH-.
Ví dụ:
Mg(OH)2 → Mg(OH)+ + OH-
Mg(OH)+ → Mg2+ + OH-
* Hiđroxit lưỡng tính: Là những hiđrôxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
A(OH)n: Zn(OH)2, Pb(OH)2, Sn(OH)2, Cu(OH)2, Al(OH)3, Cr(OH)3.
Phân li theo kiểu bazơ:
Ví dụ:
Zn(OH)2 → Zn2+ + 2OH-
Al(OH)3 → Al3+ + 3OH-
Phân li theo kiểu axit:
Ví dụ:
Zn(OH)2 → ZnO22- + 2H+
Al(OH)3 → AlO2- + H3O+
b. Axit, bazơ theo Bronsted
|
Axit là chất (hoặc ion) nhường proton H+ Bazơ là chất (hoặc ion) nhận proton H+ |
Chú ý: Anion gốc axit còn H của axit yếu (H2CO3, H2SO3, H2S, H3PO4, …) đều là chất lưỡng tính, còn anion không còn H của axit yếu đều là bazơ.
Hằng số phân li axit (Ka) và bazơ (Kb).
Ví dụ:
CH3COOH → CH3COO- + H+
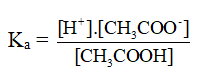
CH3COOH + H2O → CH3COO- + H+
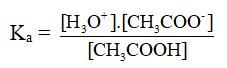
NH3 + H2O → NH4+ + OH-
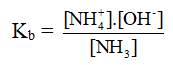
- Vì nồng độ của nước được coi như hằng số nên ta có thể bỏ qua nồng độ của nước trong biểu thức xác định hằng số phân li axit, hay bazơ.
- Đối với bazơ nhiều nấc sẽ có nhiều hằng số phân li ở các nấc khác nhau.
- Hằng số phân li bazơ chỉ phụ thuôc vào bản chất bazơ và nhiệt độ. Nếu giá trị Kb càng nhỏ thì lực bazơ của nó càng yếu (hay tính bazơ càng yếu).
- Mối liên hệ giữa hằng số Ka và Kb.
Ka = 10-14/Kb hay Ka. Kb = 10-14.
Muối axit, muối trung hoà
+ Muối axit: Muối có anion gốc axit còn khả năng phân li cho ion H+.
Ví dụ: NaHCO3; NaH2PO4; NaHSO4; ...
+ Muối trung hoà: Muối có anion gốc axit không còn khả năng phân li cho ion H+.
Ví dụ: NaCl , (NH4)2SO4, Na2CO3, ...
+ Muối bazo: Muối có nhóm –OH có thể thay thế bằng gốc axit.
Ví dụ: Mg(OH)Cl; Fe(OH)2Cl, ...
+ Ngoài ra còn kể đến một số muối kép như: HCl.NaCl; KCl.MgCl.6H2O; K2SO4.Al2(SO4)3, ...
+ Muối phức: [Ag(NH3)2]Cl; [Cu(NH3)4]SO4, ...
Sự điện li của muối trong nước: Hầu hết các muối (kể cả muối kép) khi tan trong nước phân li hoàn toàn thành cation kim loại (NH4+) và anion gốc axit.
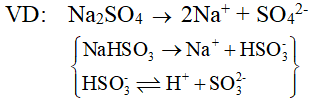
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Sự điện li
- Lý thuyết Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
- Lý thuyết Phản ứng trao đổi ion trong dung dịch chất điện li
- Lý thuyết về Axit, bazơ và muối
- Lý thuyết Phân loại các chất điện li
- Dạng 1: Bài tập lý thuyết về sự điện li, chất điện li, viết phương trình điện li
- Dạng 2: Phương pháp bảo toàn điện tích
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

