Cách giải bài tập Phản ứng oxi hóa benzene và đồng đẳng (hay, chi tiết)
Bài viết Cách giải bài tập Phản ứng oxi hóa benzene và đồng đẳng với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Phản ứng oxi hóa benzene và đồng đẳng.
Cách giải bài tập Phản ứng oxi hóa benzene và đồng đẳng (hay, chi tiết)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
A. Phương pháp giải & Ví dụ minh họa
- Oxi hóa hoàn toàn: CnH2n-6 + (3n-3)/2 O2 → n CO2 + (n-3)H2O
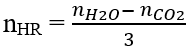
- Oxi hóa không hoàn toàn:
benzene không làm mất màu dung dịch thuốc tím ở điều kiện thường và đun nóng.
Ankyl benzene không làm mất màu dung dịch thuốc tím ở điều kiện thường nhưng làm mất màu dung dịch thuốc khi đun nóng.
C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
Ví dụ minh họa
Bài 1: Chất A là một đồng đẳng của benzene. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí CO2 ( đktc).
a. Xác định CTPT.
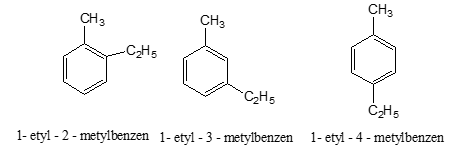
b. Viết các CTCT của A. Gọi tên.
c. Khi A tác dụng với Br2 có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vồng benzene bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định CTCT của A.
Lời giải:
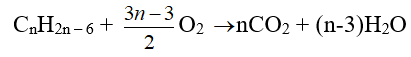
Cứ ( 14n -6)g A tạo ra n mol CO2
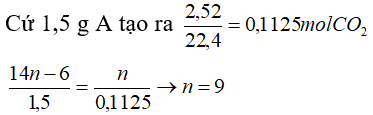
CTPT: C9H12
Các CTCT:
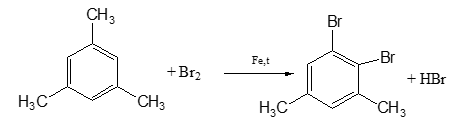
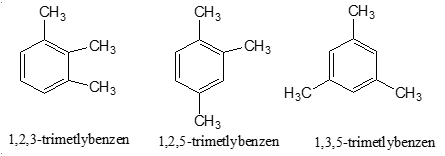
Bài 2: Đốt cháy hết 9,18 g 2 đồng đẳng của benzene A, B thu được 8,1 g H2O và CO2. Dẫn toàn bộ lượng CO2 vào 100ml dd NaOH 1M thu được m g muối. Giá trị của m và thành phần của muối:
Lời giải:
mC = 9,18 – 0,45.2 = 8,28 gam; nCO2 = 0,69 mol; T = 0,1/0,69 = 0,14 ⇒ tạo muối NaHCO3
mNaHCO3 = 0,1. 84 = 8,4 g
Bài 3: Để oxi hoá hết 10,6 gam o-xylen (1,2-dimethylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
Lời giải:
no-Xilen = 10,6/ 106 = 0,1 mol ⇒ nKMnO4 pư = 0,1.2 = 0,2 mol; dùng dư 20% ⇒ nKMnO4 = 0,2.120/100 = 0,24 mol ⇒ V = 0,24/0,5 = 0,48 lít.
Bài 4: Đốt cháy hết 9,18 g 2 đồng đẳng của benzene A, B thu được H2O và 30,36 g CO2. Cộng thức phân tử của A và B lần lượt là:
A. C8H10; C9H14 B. C8H10; C9H12
C. C8H12; C9H14 D. C8H14; C9H16
Lời giải:
nCO2 = 30,36/44 = 0,36 mol ⇒ nhh = 0,36/ntb ⇒ M = 306ntb/23 ⇒ ntb = 8,625 ⇒ CTPT A và B là: C8H10; C9H12
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn 9,2g một ankyl benzene A thu được 30,8g CO2. Công thức phân tử của A là:
A.C6H6 B. C8H10 C. C7H8 D. C9H12
Lời giải:
Đáp án: C
nCO2 = 0,7 mol; MA = 13,1n ⇒ n = 7
Bài 2: Đốt cháy 12,72 g A (CxHy) → 10,8g H2O. A có chứa 1 vòng benzene. Công thức phân tử của A là:
A. C3H4 B. C8H10 C. C9H12 D. C12H16
Lời giải:
Đáp án: C
nH2O = 0,6 mol; MA = (12,72.(n-3))/0,6 ⇒ n = 8
Bài 3: Đốt cháy hoàn toàn m g A đồng đẳng của benzene thu được 20,16 lít CO2 (đktc) và 10,8 ml H2O (lỏng). Công thức của A là:
A. C7H8 B. C8H10
C. C9H12 D. C10H14
Lời giải:
Đáp án: C
nCO2 = 20,16/22,4 = 0,9 mol; nH2O = 10,8/18 = 0,6 mol; 0,9/0,3 = n/(n-3) ⇒ n = 9
Bài 4: Đốt cháy hoàn toàn 0,1 mol CxHy thu được 15,68 lít CO2 (đktc) và 7,2 g H2O (lỏng). Công thức của CxHy là:
A. C7H8 B. C8H10 C. C10H14 D. C9H12
Lời giải:
Đáp án: A
nCO2 = 0,7 mol; nH2O = 0,4 mol; ⇒ x = 7; y = 8
Bài 5: Đốt cháy hết m gam 2 đồng đẳng của benzene A, B thu được 4,05 gam H2O và 7,728 lítCO2 (đktc). Giá trị của m và số tổng số mol của A, B là:
A. 4,59 và 0,04. B. 9,18 và 0,08. C. 4,59 và 0,08. D. 9,14 và 0,04.
Lời giải:
Đáp án: A
nCO2 = 7,728/ 22,4 = 0,345 mol; nH2O = 4,05/18 = 0,225 ⇒ m = mC + mH = 0,345.12 + 0,225.2 = 4,59 g; n = (0,345 – 0,225)/3 = 0,04 mol
Bài 6: Đốt cháy hoàn toàn ankybenzen X thu được 7,84 lít CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của X là
A.C6H6 B. C7H8 C. C8H8 D. C8H10
Lời giải:
Đáp án: B
Đặt CTPT X là CnH2n-6
3nX = nH2O - nCO2 = 0,35 – 0,2 = 0,15 mol → nX = 0,05 mol
→ 0,05n = 0,35 → n = 7 → CTPT C7H8
Bài 7: Đốt cháy hoàn toàn hydrocarbon X, thu đuộc CO2 và H2O có số mol theo tỉ lệ tương ứng 2 : 1. Mặt khác, 1 mol X tác dụng được tối đa với 4 mol H2 (Ni, t°) : 1 mol X tác dụng được tối đa 1 mol Br2. Công thức của X là.
A. C2H2 B. C4H4 C. C6H6 D. C8H8
Lời giải:
Đáp án: D
Bài 7. nC : nH = 2 : (1.2) = 1 : 1 → CTPT: CnHn
1 mol X + 4 mol H2 (Ni, to); 1 mol X + 1 mol Br2
→ X chứa vòng benzene + 1 liên kết đôi ở nhánh → k = 5
CTPT X: CnH2n+2-2k → 2n + 2 – 2k = n → k = 5; n = 8 → CTPT: C8H8
Bài 8: Đốt cháy hoàn toàn 5,3 gam ankybenzen X thu được 8,96 lít CO2 (đktc). Công thức phân tử của X là
A.C6H6 B. C7H8 C. C8H8 D. C8H10
Lời giải:
Đáp án: D
Đặt CTPT X là CnH2n-6 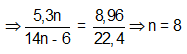
→ CTPT: C8H10
C. Bài tập tự luyện
Câu 1: Đốt cháy hoàn toàn hydrocarbon X người ta thu được CO2 và H2O theo tỉ lệ . Biết X không làm mất màu nước bromine. X là hydrocarbon nào trong số các hydrocarbon dưới đây?
A. C2H2.
B. C6H14.
C. C6H6.
D. C6H5CH3.
Câu 2: Hydrocarbon X có công thức phân tử C8H10 không làm mất màu dung dịch bromine. Khi đun nóng X với dung dịch thuốc tím tạo thành C7H5KO2 (Y). Cho Y tác dụng với dung dịch HCl tạo thành hợp chất C7H6O2. X có tên gọi là
A. 1,2-dimethylbezene.
B. 1,3-dimethylbezene.
C. 1,4-dimethylbezene.
D. ethylbenzene.
Câu 3: Đun nóng hydrocarbon thơm X có công thức phân tử C8H10 với dung dịch KMnO4 nóng thu được dung dịch có chứa C6H5COOK và K2CO3. Chất X là
A. o-xylene.
B. p-xylene.
C. ethyl benzene.
D. styrene.
Câu 4: Hydrocarbon thơm X có công thức phân tử C8H10, khi tác dụng với dung dịch KMnO4 trong môi trường H2SO4 tạo nên hợp chất hữu cơ đơn chức Y. X phản ứng với chlorine có chiếu sáng tạo hợp chất hữu cơ Z chứa một nguyên tử Cl trong phân tử (là sản phẩm chính). Các chất X, Y, Z có công thức cấu tạo lần lượt là
A. C6H5CH2CH3; C6H5COOH; C6H5CHClCH3.
B. C6H5CH2CH3; C6H5CH2COOH; C6H5CHClCH3.
C. o-CH3C6H4CH3; o-HOOCC6H4COOH; o-ClCH2C6H4CH2Cl.
D. p-CH3C6H4CH3; p-HOOCC6H4COOH; p-ClCH2C6H4CH2Cl.
Câu 5: Chất nào sau đây khi đun nóng với dung dịch KMnO4/H2SO4 tạo thành hợp chất hữu cơ đơn chức?
A. C6H5CH3.
B. m-CH3C6H4CH3.
C. o-CH3C6H4CH3.
D. p-CH3C6H4CH3.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Cách viết đồng phân, gọi tên benzene và đồng đẳng
- Dạng 2: Nhận biết, điều chế benzene và đồng đẳng
- Dạng 3: Dạng bài tập tính chất hóa học của benzene và đồng đẳng
- Dạng 4: Phản ứng thế của benzene
- Dạng 5: Phản ứng trùng hợp của styrene
- Dạng 7: Nguồn hydrocarbon thiên nhiên
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

