42+ Bài tập trắc nghiệm tổng hợp Tính chất hóa học của oxit và axit (có lời giải)
Với câu hỏi & bài tập trắc nghiệm Luyện tập: Tính chất hóa học của oxit và axit lớp 9 có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm bài tập trắc nghiệm Luyện tập: Tính chất hóa học của oxit và axit.
42+ Bài tập trắc nghiệm tổng hợp Tính chất hóa học của oxit và axit (có lời giải)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Câu 1: Các dung dịch đều làm quỳ tím chuyển đỏ là
A. NaCl, HCl.
B. HCl, H2SO4.
C. NaOH, KOH.
D. NaCl, NaOH.
Câu 2: Chất dùng để phân biệt các dung dịch không màu : HCl, H2SO4 loãng, BaCl2 là:
A. dd NaOH
B. dd KOH
C. Qùy tím
D. dd NaCl
Câu 3: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. rót từng giọt nước vào axit.
B. rót từng giọt axit vào nước.
C. cho cả nước và axit vào cùng một lúc.
D. cả 3 cách trên đều được.
Câu 4: Khi pha loãng axit sunfuric người ta phải
A. đổ từ từ axit vào nước
B. đổ từ từ nước vào axit
C. đổ nhanh axit vào nước
D. đổ nhanh nước vào axit
Câu 5: Khi pha loãng axit sunfuric từ axit đặc người ta phải:
A. đổ từ từ axit đặc vào nước
B. đổ từ từ nước vào axit đặc
C. đổ nhanh axit đặc vào nước
D. đổ nhanh nước vào axit đặc
Câu 6: Kim loại nào sau đây không tác dụng được với dung dịch axit HCl?
A. Al
B. Fe
C. Na
D. Cu
Câu 7: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Cu, Zn, Na.
B. Au, Pt, Cu.
C. Ag, Ba, Fe.
D. Mg, Fe, Zn.
Câu 8: Dung dịch H2SO4 loãng phản ứng được với :
A. Au.
B. Fe.
C. Ag.
D. Cu.
Câu 9: Để nhận biết dung dịch H2SO4, người ta thường dùng
A. dung dịch NaOH.
B. dung dịch KCl.
C. dung dịch BaCl2.
D. dung dịch CuSO4.
Câu 10: Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
A. Xuất hiện kết tủa hồng.
B. Xuất hiện kết tủa trắng.
C. Xuất hiện kết tủa xanh lam.
D. Xuất hiện kết tủa nâu đỏ.
Câu 11: Để nhận biết axit sunfuric và muối sunfat người ta thường dùng
A. BaCl2
B. Ba3(PO4)2
C. BaCO3
D. BaSO4
Câu 12: Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện
A. Xuất hiện kết tủa màu trắng
B. Xuất hiện kết tủa màu xanh lam
C. Có bọt khí thoát ra khỏi dung dịch
D. Chất kết tủa màu đỏ
Câu 13: Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
A. Fe
B. Zn
C. Mg
D. Al
Câu 14: Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
A. Zn
B. Fe
C. Mg
D. Al
Câu 15: Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4 ?
A. NaOH
B. Ba(OH)2
C. Fe
D. CaO
Câu 16: Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
A. 30%.
B. 50%.
C. 40%.
D. 60%.
Câu 17: Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
A. 100 ml.
B. 80 ml.
C. 90 ml.
D. 120 ml.
Câu 18: Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
A. 30,240.
B. 29,568.
C. 29,792.
D. 27,328.
Câu 19: Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 63% và 37%
C. 61,5% và 38,5%
D. 65% và 35%
Câu 20: Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
A. 22,22%.
B. 14,45%.
C. 24,13%.
D. 15,76%.
Câu 21: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Câu 22: Hoà tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
A. 26,3 g
B. 40,5 g
C. 19,2 g
D. 22,8 g
Câu 23: Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
A. 15,12.
B. 8,40.
C. 6,72.
D. 8,96.
Câu 24: Cho 2,44 gam hỗn hợp muối Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch H2SO4 0,5M, sau phản ứng thu được 0,448 lít CO2 ở đktc. Thể tích dung dịch H2SO4 0,5 M cần dùng là:
A. 100 ml
B. 40ml
C. 30 ml
D. 25 ml
Câu 25: Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
A. 3,36.
B. 4,48.
C. 2,24.
D. 1,12.
Câu 26: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là:
A. 2,5 lít
B. 0,25 lít
C. 3,5 lít
D. 1,5 lít
Câu 27: Hoà tan 2,84 gam hỗn hợp 2 muối CaCO3 và MgCO3 bằng dung dịch HCl dư thu được 0,672 lít khí CO2 (đktc). Thành phần % số mol mỗi muối trong hỗn hợp lần lượt là:
A. 50% và 50%
B. 33% và 67%
C. 75% và 25%
D. 67% và 33%
Câu 28: Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
A. CuO, Cu, K2O, CO.
B. SO2, CuO, Fe, CO2.
C. KOH, CuO, Fe, BaCl2.
D. CuO, CO2, MgO, K2O.
Câu 29: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg.
B. Zn, Fe, Cu.
C. Zn, Fe, Al.
D. Fe, Zn, Ag
Câu 30: Dung dịch HCl không tác dụng với chất nào sau đây?
A. CuO.
B. Ag.
C. NaOH.
D. AgNO3.
Câu 31: Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3, CO2 .
B. K2O, P2O5, CaO.
C. BaO, SO3, P2O5.
D. CaO, BaO, Na2O.
Câu 32: Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
A. 1
B. 2
C. 3
D. 4
Câu 33: Công thức hóa học của axit sunfuric là:
A. HCl.
B. H2SO3.
C. H2SO4.
D. HClO.
Câu 34: hydrochloric acid có công thức hóa học là:
A. H2SO4
B. HCl
C. H3PO4
D. H2CO3
Câu 35: Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
A. Fe
B. Cu.
C. Mg.
D. Al
Câu 36: Dãy các chất không tác dụng được với dung dịch H2SO4 loãng là:
A. Zn, ZnO, Zn(OH)2.
B. Cu, CuO, Cu(OH)2.
C. Na2O, NaOH, Na2CO3.
D. MgO, MgCO3, Mg(OH)2.
Câu 37: Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
A. FeSO4
B. H2O
C. SO2
D. Fe2(SO4)3
Câu 38: Sự khác biệt trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
A. tác dụng được với basic oxide
B. tác dụng được với bazơ
C. tác dụng được với kim loại
D. khả năng hút nước mạnh (tính háo nước)
Câu 39: Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng kim loại
A. Mg
B. Ba
C. Cu
D. Zn
Câu 40: Thuốc thử dùng để nhận biết dung dịch HCl và dung dịch H2SO4 là:
A. K2SO4
B. Ba(OH)2
C. NaCl
D. NaNO3
Câu 41: Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
A. Không xảy ra hiện tượng gì
B. Đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
C. Đường tan trong axit tạo dung dịch trong suốt, không có bọt khí thoát ra
D. Đường tan trong axit tạo dung dịch trong suốt, có bọt khí thoát ra.
Câu 42: Khả năng tan của H2SO4 trong nước là
A. rất ít
B. ít
C. bình thường
D. nhiều
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm câu hỏi trắc nghiệm Hóa học lớp 9 có lời giải chi tiết hay khác:
- 58+ Bài tập trắc nghiệm Tính chất hóa học của oxit. Khái quát về sự phân loại oxit (có lời giải)
- 35+ Bài tập trắc nghiệm Một số oxit quan trọng (có lời giải)
- 15+ Bài tập trắc nghiệm Tính chất hóa học của axit (có lời giải)
- 39+ Bài tập trắc nghiệm Một số axit quan trọng (có lời giải)
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều

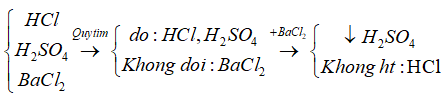

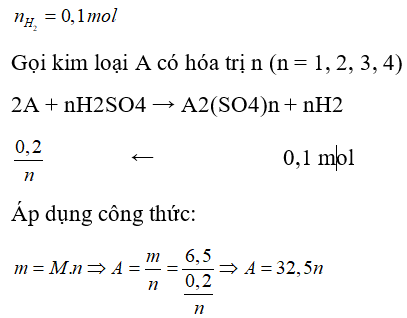


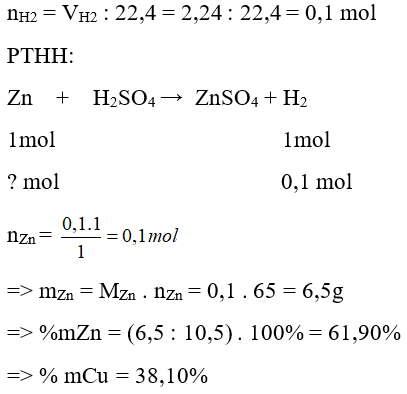
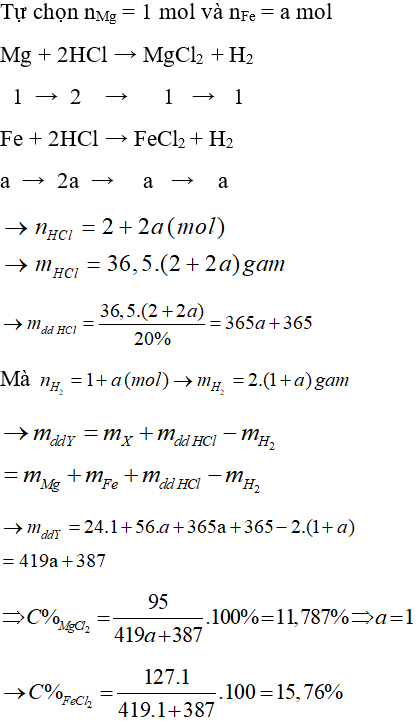
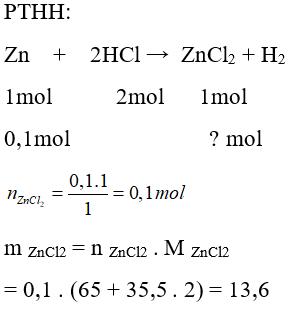
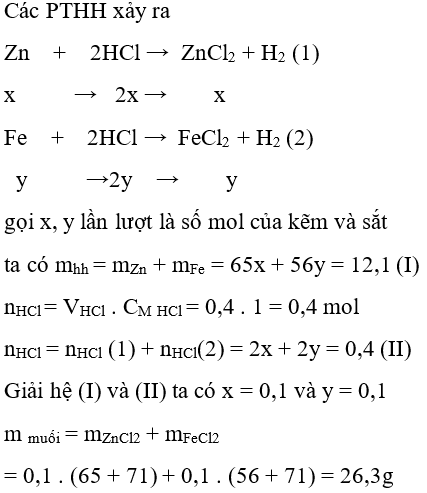
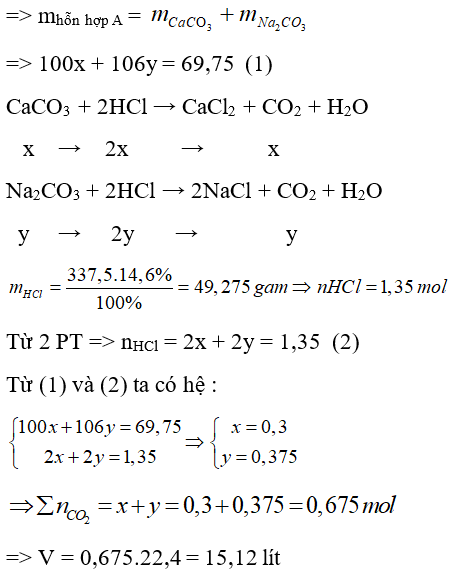
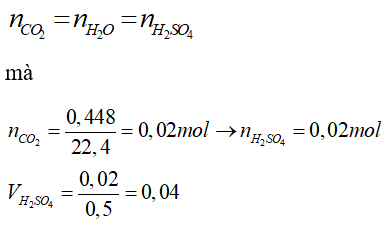
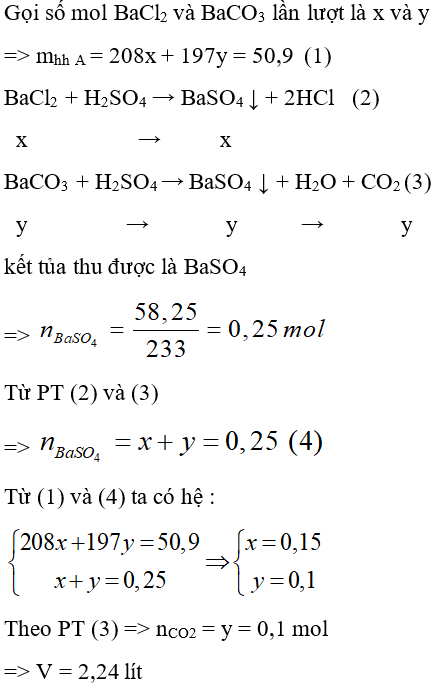
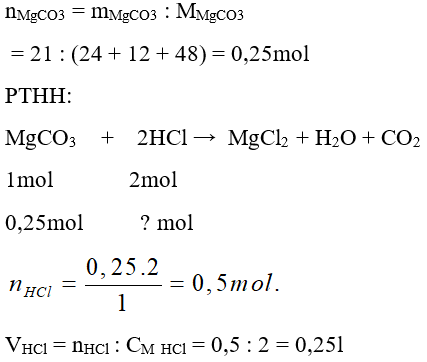
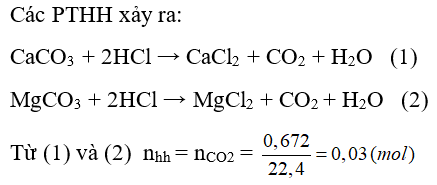
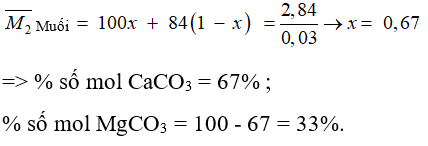
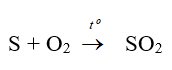
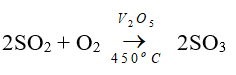
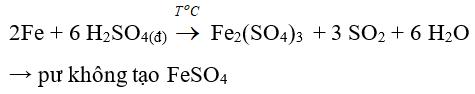
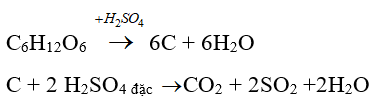



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

