15+ Bài tập về Các oxit của cacbon lớp 9 (có lời giải)
Tổng hợp trên 15 Bài tập về Các oxit của cacbon Hóa học lớp 9 có lời giải chi tiết gồm các câu hỏi & bài tập trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng sẽ giúp học sinh biết cách làm bài tập Hóa 9.
15+ Bài tập về Các oxit của cacbon lớp 9 (có lời giải)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
A/ Bài tập về các oxit của cacbon
Bài 1: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, Cu, MgO, Fe.
B. Al, Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Fe2O3, Cu, MgO.
Lời giải
Khí CO chỉ khử được các oxit kim loại đứng sau Al => khử được CuO và Fe2O3
Đáp án: A
Bài 2: Trong các phản ứng hoá học sau, phản ứng nào sai?
A. 3CO + Fe2O3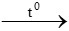 3CO2 + 2Fe
3CO2 + 2Fe
B. CO + Cl2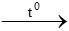 COCl2
COCl2
C. 3CO + Al2O3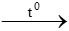 2Al + 3CO2
2Al + 3CO2
D. 2CO + O2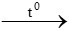 2CO2
2CO2
Lời giải
Phản ứng hóa học sai là 3CO + Al2O3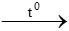 2Al + 3CO2 vì CO không khử được Al2O3
2Al + 3CO2 vì CO không khử được Al2O3
Đáp án: C
Bài 3: Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta sử dụng mặt nạ với chất hấp phụ là
A. Copper (II) oxide và mangan oxit.
B. Copper (II) oxide và magnesium oxide.
C. Copper (II) oxide và than hoạt tính.
D. than hoạt tính.
Lời giải
Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta dùng chất hấp thụ là than hoạt tính.
Vì CuO và MnO có phản ứng với CO nhưng ở nhiệt độ cao
MgO không phản ứng với CO
Đáp án: D
Bài 4: Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hoá học nào sau đây?
A. CaCO3 + CO2 +H2O → Ca(HCO3)2
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
C. CaCO3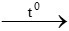 CaO + CO2
CaO + CO2
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O
Lời giải
Sự hình thành thạch nhũ:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Sư xâm thực đá vôi (quá trình hòa tan núi đá vôi):
CaCO3 + CO2 +H2O → Ca(HCO3)2
Đáp án: D
Bài 5: “Nước đá khô“ không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là
A. CO rắn. B. SO2 rắn.
C. H2O rắn. D. CO2 rắn.
Lời giải
Nước đá khô là CO2 rắn
Đáp án: D
Bài 6: Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
A. H2. B. N2.
C. CO2. D. O2.
Lời giải
Chất khí gây ra hiệu ứng nhà kính là CO2
Đáp án: C
Bài 7: Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
A. Dung dịch NaOH đặc.
B. Dung dịch Na2CO3 bão hoà và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4 đặc.
D. Dung dịch NaHCO3 bão hoà và dung dịch H2SO4 đặc.
Lời giải
A loại vì NaOH phản ứng với CO2 và HCl
B loại vì Na2CO3 phản ứng với CO2 và HCl
C loại vì H2SO4 đặc chỉ tách được nước, không tách được CO2 và HCl.
D đúng vì NaHCO3 chỉ phản ứng với HCl sinh ra khí CO2 và dung dịch H2SO4 để hút nước.
NaHCO3 + HCl →NaCl + CO2 + H2O
Đáp án: D
Bài 8: Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất nào sau đây?
A. CO2 là chất nặng hơn không khí
B. CO2 là chất khí không màu, không mùi.
C. CO2 không duy trì sự cháy và sự sống.
D. CO2 bị nén và làm lạnh hóa rắn.
Lời giải
Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất : CO2 là chất nặng hơn không khí
Đáp án: A
Bài 9: Có thể dùng thuốc thử nào sau đây để phân biệt khí CO2 và khí CO?
A. dung dịch NaCl.
B. dung dịch CuSO4.
C. dung dịch HCl.
D. dung dịch Ca(OH)2 dư.
Lời giải
Để phân biệt khí CO2 và khí CO, ta dùng dung dịch Ca(OH)2 dư vì CO2 tạo kết tủa trắng còn CO không phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O
Đáp án: D
Bài 10: Trong bình chữa cháy chứa khí nào sau đây?
A. Cl2. B. CO2.
C. SO2. D. O2
Lời giải
Trong bình chữa cháy chứa khí CO2
Đáp án: B
B/ Bài tập co tác dụng với oxit kim loại
Bài 1: Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
A. Cu, Fe, ZnO, MgO.
B. Cu, Fe, Zn, Mg.
C. Cu, Fe, Zn, MgO.
D. Cu, FeO, ZnO, MgO.
Lời giải
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ
=> chỉ khử được CuO, Fe2O3, ZnO tạo thành Cu, Fe, Zn
=> hỗn hợp chất rắn thu được là Cu, Fe, Zn, MgO.
Đáp án: C
Bài 2: Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
A. MgO, Fe3O4, Cu.
B. MgO, Fe, Cu.
C. Mg, Fe, Cu.
D. Mg, Al, Fe, Cu.
Lời giải
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
=> trong hỗn hợp X, CO khử được Fe3O4 và CuO tạo ra Fe và Cu
=> chất rắn Y gồm: Al2O3, MgO, Fe, Cu
Cho Y vào dung dịch NaOH dư, chỉ có Al2O3 tan => chất rắn Z sau phản ứng gồm MgO, Fe, Cu
Đáp án: B
Bài 3: Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
A. 12,8 B. 25,6
C. 32,0 D. 16,0
Lời giải
PTHH: CuO + CO 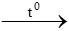 Cu + CO2
Cu + CO2
=> nCu = nCuO = 0,4 mol => mCu = 25,6 gam
Đáp án: B
Bài 4: Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
A. 17,6 B. 4,8
C. 20,8 D. 24,0
Lời giải
MgO không phản ứng với CO
PTHH: CuO + CO 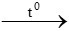 Cu + CO2
Cu + CO2
0,2 → 0,2
Chất rắn gồm MgO và Cu
=> x = mMgO + mCu = 0,2.40 + 0,2.64 = 20,8 gam
Đáp án: C
Bài 5: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam. B. 8,3 gam.
C. 2,0 gam. D. 4,0 gam.
Lời giải
Gọi số mol của CuO và Al2O3 lần lượt là a và b mol
=> mhỗnhợpđầu = 80a + 102b = 9,1 (1)
Khí CO chỉ phản ứng với CuO
CuO + CO 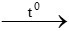 Cu + CO2
Cu + CO2
a mol → a mol
Hỗn hợp chất rắn sau phản ứng gồm Cu (a mol) và Al2O3 (b mol)
=> mhỗnhợp sau = 64a + 102b = 8,3 (2)
Lấy (1) trừ (2) ta có: 16a = 0,8 => a = 0,05 mol
=> mCuO = 0,05.80 = 4 gam
Đáp án: D
Bài 6: Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
A. 0,224 B. 0,560
C. 0,112 D. 0,448
Lời giải
Giả sử khối lượng hỗn hợp rắn ban đầu là m gam => khối lượng rắn sau phản ứng là (m – 0,32) gam
CO + CuO 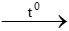 Cu + CO2
Cu + CO2
3CO + Fe2O3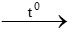 2Fe + 3CO2
2Fe + 3CO2
Từ 2 PTHH ta có: nCO = nCO2 = a mol
Bảo toàn khối lượng:
mCO + mCuO,Fe2O3 = mCO2 + mrắn sau phản ứng
=> 28a + m = 44a + m – 0,32
=> a = 0,02 mol
=> V = 0,02.22,4 = 0,448 lít
Đáp án: D
Bài 7: Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là
A. 0,896 B. 1,120
C. 0,224 D. 0,448
Lời giải
CO + CuO 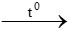 Cu + CO2
Cu + CO2
3CO + Fe2O3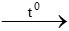 2Fe + 3CO2
2Fe + 3CO2
Từ 2 PTHH => nCO = nCO2
Cho khí X vào dung dịch Ca(OH)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
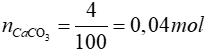
Theo PTHH: nCO2 = nCaCO3 = 0,04 mol
=> nCO = 0,04 mol
=> V = 0,04.22,4 = 0,896 lít
Đáp án: A
Bài 8: Hoà tan hoàn toàn 20 gam một oxit kim loại bằng dung dịch H2SO4 loãng thu được 50 gam muối. Khử hoàn toàn lượng oxit đó thành kim loại ở nhiệt độ cao cần V lít khí CO (đktc). Giá trị của V là
A. 2,80 B. 5,60
C. 6,72 D. 8,40
Lời giải
Gọi oxit kim loại cần tìm là R2On
R2On + nH2SO4 → R2(SO4)n + nH2O
Theo PTHH ta có:
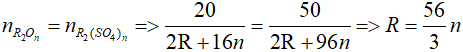
Ta có bảng sau:
n |
1 |
2 |
3 |
4 |
R |
18,67 (loại) |
37,33 (loại) |
56 (Fe) |
74,67 (loại) |
=> oxit cần tìm là Fe2O3
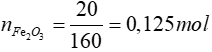
Fe2O3 + 3CO 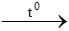 2Fe + 3CO2
2Fe + 3CO2
0,125 → 0,375
=> VCO = 0,375.22,4 = 8,4 lít
* Trường hợp oxit kim loại là Fe3O4
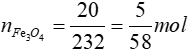
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
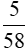 mol →
mol → 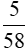 mol →
mol → 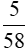 mol
mol
=> Khối lượng muối thu được là:
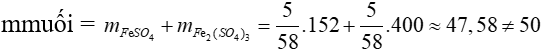
=> loại trường hợp này
Đáp án: D
Bài 9: Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, Al2O3 và FexOy nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H2O và a gam chất rắn. Giá trị của a là :
A. 6,70 B. 6,86
C. 6,78 D. 6,80
Lời giải
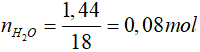
H2 + CuO  Cu + H2O
Cu + H2O
yH2 + FexOy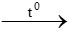 xFe + yH2O
xFe + yH2O
Từ PTHH ta có:
nH2 = nH2O =0,08 mol
Bảo toàn khối lượng:
mH2 = mhhA= mcran + mH2O
=> 0,08.2 + 8,14 = a + 1,44 => a = 6,86 gam
Đáp án: B
Bài 10: Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
A. Fe3O4. B. Fe2O3.
C. FeO. D. ZnO.
Lời giải
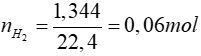
TH1: M không phải là Fe3O4
M2On + nH2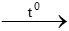 2M + nH2O
2M + nH2O
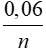 ← 0,06 →
← 0,06 → 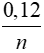
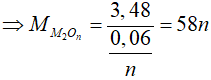
=> 2M + 16n = 58n => M = 21n
Ta có bảng sau:
n |
1 |
2 |
3 |
4 |
M |
21 (loại) |
42 (loại) |
63 (loại) |
84 (loại) |
=> loại trường hợp này
TH2: M là Fe3O4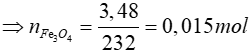
Fe3O4 + 4H2 3Fe + 4H2O
0,015 → 0,06 → 0,045 mol
Fe + 2HCl → FeCl2 + H2
0,045 mol → 0,045 mol
⇒VH2 = 0,045.22,4 = 1,008 lít (phù hợp đầu bài)
Vậy oxit cần tìm là Fe3O4
Đáp án: A
Bài 11: Cho khí CO qua ống chứa 15,2 gam hỗn hợp A gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là :
A. 15 B. 10
C. 20 D. 25
Lời giải
CO + CuO  Cu + CO2
Cu + CO2
CO + FeO 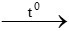 Fe + CO2
Fe + CO2
Từ PTHH ta có: nCO = nCo2 = a mol
Bảo toàn khối lượng: mCO + mhhA = mCo2 + mhhB
=> 28a + 15,2 = 44a + 13,6 => a = 0,1 mol
B tác dụng với dung dịch Ca(OH)2 dư:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,1 mol → 0,1 mol
=> mkếttủa = 0,1.100 = 10 gam
Đáp án: B
Bài 12: Dẫn một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của m là :
A. 6,24 B. 5,32
C. 3,12 D. 4,56
Lời giải
4CO + Fe3O4 → 3Fe + 4CO2
CO + CuO → Cu + CO2
Từ PTHH ta có: nCO = nCo2 = a mol
Khí thoát ra khỏi bình dẫn qua dung dịch Ca(OH)2 thu được 5 gam kết tủa CaCO3
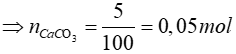
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 mol ← 0,05 mol
Bảo toàn khối lượng:
mCO + mhh Fe3O4, CuO = mCO2 + mhhkl
=> 0,05.28 + m = 0,05.44 + 2,32 => m = 3,12 gam
Đáp án: C
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm bộ câu hỏi trắc nghiệm Hóa học lớp 9 chọn lọc, có đáp án mới nhất hay khác:
- Bài tập về carbonic acid và muối carbonate lớp 9 (có lời giải)
- Bài tập về Silic. Công nghiệp silicat lớp 9 (có lời giải)
- Bài tập về Sơ lược về bảng tuần hoàn các nguyên tố hóa học lớp 9 (có lời giải)
- Bài tập về Khái niệm về hợp chất hữu cơ và hóa học hữu cơ lớp 9 (có lời giải)
- Bài tập về Cấu tạo phân tử hợp chất hữu cơ lớp 9 (có lời giải)
- Bài tập về methane lớp 9 (có lời giải)
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

