Tóm tắt công thức Hóa học vô cơ lớp 9 hay, chi tiết
Tóm tắt công thức Hóa học vô cơ lớp 9 hay, chi tiết
Với mục đích giúp học sinh dễ dàng hơn trong việc nhớ kiến thức & công thức môn Hóa học lớp 9, VietJack biên soạn bản Tóm tắt công thức Hóa học vô cơ lớp 9 hay, chi tiết. Hi vọng loạt bài này sẽ như là cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa học lớp 9.
- Tóm tắt công thức Hóa học lớp 9 Chương 1
- Tóm tắt công thức Hóa học lớp 9 Chương 2
- Tóm tắt công thức Hóa học lớp 9 Chương 3
CHƯƠNG I: CÁC LOẠI HỢP CHẤT VÔ CƠ
I. Bài toán CO2 (hoặc SO2) tác dụng với dung dịch kiềm
Dung dịch kiềm thường được sử dụng:
Nhóm 1: NaOH, KOH …(kim loại hóa trị I; công thức chung MOH)
Nhóm 2: Ca(OH)2, Ba(OH)2 …(kim loại hóa trị II, công thức chung M(OH)2)
1. Bài toán dẫn khí CO2 (hoặc SO2) vào dung dịch kiềm MOH
Đặt T = 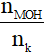
+ T ≥ 2: chỉ tạo muối trung hòa;
+ T ≤ 1: chỉ tạo muối axit;
+ 1 < T < 2: thu được cả muối trung hòa và muối axit.
Chú ý: mbình tăng = mchất hấp thụ
Ví dụ: Dẫn 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng chứa:
A. NaHCO3 B. Na2CO3
C. Na2CO3 và NaOH D. NaHCO3 và NaOH
Giải:
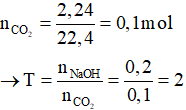
Vậy sau phản ứng CO2 và NaOH đều hết, sản phẩm thu được là Na2CO3.
2. Bài toán dẫn khí CO2 (hoặc SO2) vào dung dịch kiềm M(OH)2
Đặt T =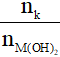
+ T ≤ 1: chỉ tạo muối trung hòa
+ T ≥ 2: chỉ tạo muối axit
+ 1 < T < 2: thu được cả muối trung hòa và muối axit.
Ngoài ra:
mbình tăng = mchất hấp thụ
mdd tăng = mchất hấp thụ - mkết tủa
mdd giảm = mkết tủa – mchất hấp thụ
CHƯƠNG II: KIM LOẠI
1. Dãy hoạt động hóa học của một số kim loại
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
2. Tính khối lượng muối thu được khi cho kim loại phản ứng hết với HCl (hoặc H2SO4 loãng)
Tổng quát: mmuối = mKL + mgốc axit
m muốisunfat = m hỗn hợp KL + 96.nH2
Và m muối clorua = mhỗn hợp KL +71.nH2
3. Bài toán cho kim loại tác dụng với dung dịch muối
Phương trình hóa học tổng quát:
Kim loại (tan ra) + Muối → Muối mới + Kim loại mới (bám vào)
+ Nếu đề bài cho khối lượng thanh kim loại tăng hay giảm là m (gam) thì áp dụng như sau:
- Khối lượng thanh kim loại tăng lên so với trước khi nhúng ta có:
mkim loại bám vào - mkim loại tan ra = mtăng
- Khối lượng thanh kim loại giảm so với trước khi nhúng ta có:
mkim loại tan ra - mkim loại bám vào = mgiảm
+ Nếu đề bài cho khối lượng thanh kim loại tăng hay giảm là x% thì ta áp dụng như sau:
- Khối lượng thanh kim loại tăng lên x% so với trước khi nhúng ta có:
m kim loại bám vào - mkim loại tan ra = mbđ.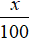
- Khối lượng thanh kim loại giảm xuống x% so với trước khi nhúng ta có:
mkim loại tan ra - mkim loại bám vào = mbđ.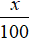
Với mbđ là khối lượng ban đầu của thanh kim loại hoặc đề sẽ cho sẵn khối lượng kim loại ban đầu.
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

