Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Video Giải bài tập Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại - Cô Phạm Thị Thu Phượng
Bài 1 (trang 82 SGK Hóa 12 - Video giải tại 14:02): Hãy cho biết vị trí của kim loại trong bảng tuần hoàn?
Lời giải:
Trong bảng tuần hoàn có gần 90 nguyên tố kim loại, chúng nằm ở các vị trí như sau:
- Nhóm IA (trừ hiđro) và nhóm IIA.
- Nhóm IIIA (trừ Bo) và một phần của các nhóm IVA, VA, VIA.
Các nhóm B từ IB đến VIIIB.
- Họ lantan và họ actini được xếp riêng thành hai hàng ở cuối bảng.
Bài 2 (trang 82 SGK Hóa 12 - Video giải tại 16:22): Nguyên tử kim loại và tinh thể kim loại có cấu tạo như thế nào ?
Lời giải:
- Cấu tạo của nguyên tử kim loại.
+ Có số electron hóa trị ít.
+ Trong cùng một chu kì các nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tố phi kim trong cùng chu kì.
- Cấu tạo tinh thể kim loại.
+ Kim loại có cấu tạo tinh thể, tinh thể kim loại có cấu tạo mạng.
+ Có 3 loại kiểu mạng tinh thể phổ biến là : Mạng tinh thể luc phương , mạng tinh thể lập phương tâm diện , mạng tinh thể lập phương tâm khối.
Bài 3 (trang 82 SGK Hóa 12 - Video giải tại 19:03): Liên kết kim loại là gì? So sánh với liên kết ion và liên kết cộng hóa trị ?
Lời giải:
Liên kết kim loại là liên kết sinh ra bởi lực hút tĩnh điện giữa các electron tự do và các ion dương, kết dính các ion dương kim loại với nhau.
So sánh liên kết kim loại với liên kết cộng hóa trị:
- Giống nhau: có sự dùng chung electron.
- Khác nhau:
+ Liên kết cộng hóa trị: sự dùng chung electron giũa hai nguyên tử tham gia liên kết.
+ Liên kết kim loại: sự dùng chung electron toàn bộ electron trong nguyên tử kim loại.
So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
Bài 4 (trang 82 SGK Hóa 12 - Video giải tại 25:46): Mạng tinh thể kim loại gồm có:
A. Nguyên tử, ion kim loại và ác electron độc thân.
B. Nguyên tử, ion kim loại và các electron tự do.
C. Nguyên tử kim loại và các electron độc thân.
D. Ion kim loại và các electron độc thân.
Lời giải:
Đáp án B.
Bài 5 (trang 82 SGK Hóa 12 - Video giải tại 26:56): Cho cấu hình electron :1s22s22p6
Dãy nào sau đây gồm các nguyên tử và ion có cấu hình electron như trên.
A. K+, Cl, Ar
B. Li+, Br, Ne
C. Na+, Cl, Ar
D. Na+, F-, Ne
Lời giải:
Đáp án D.
Bài 6 (trang 82 SGK Hóa 12 - Video giải tại 29:12): Cation R+ có cấu hình electron phân lớp ngoài cùng là 2p6. Nguyên tử P là
A. F.
B. Na.
C. K.
D. Cl.
Lời giải:
Đáp án B
Cấu hình e của R+ là: 1s22s22p6
⇒ cấu hình e của R là: 1s22s22p63s1 ⇒ R là Na
Bài 7 (trang 82 SGK Hóa 12 - Video giải tại 30:08): Hòa tan 1,44 gam một kim loại hóa trị II trong 150ml dung dịch H2SO4 0,5M. Muốn trung hòa axit dư trong dung dịch thu được, phải dùng hết 30ml dung dịch NaOH 1M. Kim loại đó là :
A. Ba.
B. Ca.
C. Mg.
D. Be.
Lời giải:
Đáp án C.
Gọi kim loại cần tìm là R. Các PTHH:
R + H2SO4 → RSO4 +H2 (1)
H2SO4 + 2NaOH → Na2SO4 + H2O (2)
Số mol H2SO4 là nH2SO4 = 0,15.0,5 = 0,075 (mol);
Số mol NaOH là nNaOH = 0,03.1 = 0,03 (mol)
Theo pt (2) 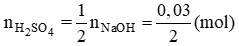
Số mol H2SO4 phản ứng (1) là:
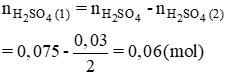
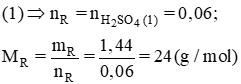
Vậy R là Mg.
Bài 8 (trang 82 SGK Hóa 12 - Video giải tại 33:18): Hòa tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 0,6 gam khí H2 bay ra. Khối lượng muối tạo ra trong dung dịch là :
A. 36,7 g.
B. 35,7 g.
C. 63,7 g.
D. 53,7 g.
Lời giải:
Số mol H2 là nH2 = 0,6/2 = 0,3(mol)
PTHH : Mg + 2HCl → MgCl2 + H2 ↑ (1)
Zn + 2HCl → ZnCl2 + H2 ↑ (2)
Gọi x, y lần lượt là số mol của Mg và Zn trong dung dịch x, y > 0
nH2 = x + y = 0,3 mol.
mhh = 24x + 65y = 15,4.
Khối lượng muối là m = x(24 + 71) + y(65 + 71)
m = 24x + 65y + 71(x + y) = 15,4 + 71.0,3 = 36,7 (g)
Bài 9 (trang 82 SGK Hóa 12 - Video giải tại 36:52): Cho 12,8 gam kim loại A hóa trị II phản ứng hoàn toàn với khí Cl2 thu muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh sắt nặng 11,2 gam vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh sắt và khối lượng thanh sắt là 12,0 gam, nồng độ FeCl2 trong dung dịch là 0,25M. Xác định kim loại A và nồng độ mol của kim loại B trong dung dịch C.
Lời giải:
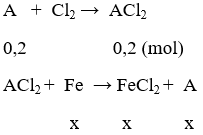
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 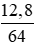
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 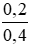
Xem thêm các bài Giải bài tập Hóa học 12 (có video) hay khác:
- Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- Bài 19: Hợp kim
- Bài 20: Sự ăn mòn kim loại
- Bài 21: Điều chế kim loại
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

