Lý thuyết Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại (Hóa 12 Chân trời sáng tạo Bài 14)
Với tóm tắt lý thuyết Hóa 12 Bài 14: Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại (Hóa 12 Chân trời sáng tạo Bài 14)
(199k) Xem Khóa học Hóa 12 CTST
I. CẤU TẠO CỦA KIM LOẠI
1. Đặc điểm cấu tạo nguyên tử của kim loại
- Đa số các nguyên tử kim loại có số electron ở lớp ngoài cùng là 1, 2, 3.
Cấu hình electron nguyên tử cuả một số nguyên tố kim loại:
- Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim.
2. Trình bày đặc điểm cấu tạo tinh thể kim loại
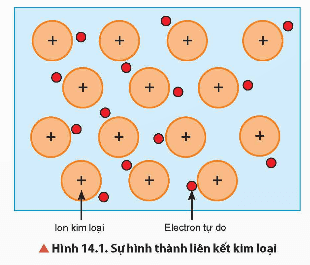
Ở nhiệt độ thường, trừ thuỷ ngân ở thể lỏng, các kim loại khác ở thể rắn và có cấu tạo tinh thể. Trong tinh thể kim loại, ion kim loại nằm ở nút mạng, các electron hoá trị chuyển động tự do.
3. Đặc điểm của liên kết kim loại
Trong tinh thể kim loại lực hút tĩnh điện giữa các ion dương ở nút mạng với các electron hoá trị chuyển động tự do tạo nên liên kết kim loại.
II. TÍNH CHẤT VẬT LÝ CỦA KIM LOẠI
- Kim loại có tính chất vật lý chung: tính ánh kim, tính dẫn điện, tính dẫn nhiệt và tính dẻo.
+ Kim loại có ánh kim vì electron tự do trong tinh thể kim loại phản xạ ánh sáng trong vùng nhìn thấy. Nhờ có ánh kim, một số kim loại được dùng làm đồ trang sức hay làm các vật dụng trang trí.
+ Kim loại dẫn điện vì electron tự do chuyển động từ hỗn loạn sang có hướng khi đặt một hiệu điện thế ở hai đầu kim loại. Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al, Fe, ... Những kim loại có tính dẫn điện tốt được dùng làm dây dẫn điện như Cu, Al.
+ Kim loại dẫn nhiệt vì khi tăng nhiệt độ từ một vị trí ở đó ion kim loại dao động mạnh truyền năng lượng sang các electron tự do rồi các electron tự do truyền sang các ion kim loại lân cận …làm tăng nhiệt độ toàn khối kim loại.
Nhìn chung, những kim loại dẫn điện tốt thì cũng dẫn nhiệt tốt. Kim loại có tính dẫn dẫn nhiệt tốt có thể được dùng làm dụng cụ đun nấu.
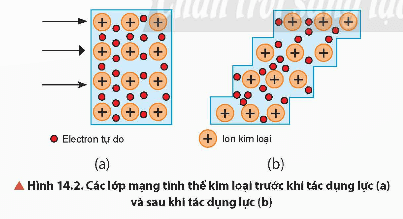
+ Kim loại có tính dẻo là nhờ electron tự do liên kết các lớp mạng trong tinh thể với nhau và chúng có thể trượt lên nhau khi chịu tác dụng của một lực cơ học nhưng không tách rời khỏi nhau.
Những kim loại có tính dẻo cao như Au, Ag, Al, Cu, Sn, ... có thể được kéo sợi, rèn, dát mỏng…tạo nên các đồ vật khác nhau với nhiều hình dáng mẫu mã đẹp.
- Kim loại có một số tính chất vật lí riêng như khối lượng riêng, nhiệt độ nóng chảy, độ cứng...
+ Kim loại có khối lượng riêng nhỏ nhất là Li(0,53 g/cm3) và lớn nhất là Os (22,59 g/cm3).
+ Kim loại có nhiệt độ nóng chảy thấp nhất là Hg (-39 °C) và cao nhất là W (3 410 °C). Kim loại có độ cứng lớn nhất là Cr (có thể cắt được kính), mềm nhất là các kim loại nhóm IA như K, Rb, Cs…
III. TÍNH CHẤT HOÁ HỌC CỦA KIM LOẠI
Tính chất hoá học đặc trưng của kim loại là tính khử:
M → Mn+ + ne
1. Phản ứng của kim loại với phi kim
- Hầu hết các kim loại (trừ Au, Pt …) có thể phản ứng với chlorine tạo thành muối chloride. Ví dụ:
2Fe + 3Cl2 2FeCl3
Mg + Cl2 MgCl2
- Hầu hết các kim loại có thể phản ứng với oxygen (trừ Ag, Au, Pt) tạo thành các oxide tương ứng. Ví dụ:
3Fe + 2O2Fe3O4
2Mg + O2 2MgO
- Nhiều kim loại có thể khử lưu huỳnh tạo thành các muối sulfide tương ứng. Phản ứng cần đun nóng (trừ Hg).
Fe + S FeS
Hg + S → HgS
2. Sử dụng bảng giá trị thế điện cực chuẩn của một số cặp oxi hoá - khử phổ biến để giải thích một số phản ứng của kim loại
a) Kim loại phản ứng với dung dịch HCl hoặc dung dịch H2SO4
Kim loại có thế điện cực chuẩn âm có khả năng khử được ion H+ (dung dịch HCl, H2SO4 loãng) ở điều kiện chuẩn, giải phóng khí H2.
Ví dụ: nên Fe phản ứng được với dung dịch HCl hoặc H2SO4 loãng sinh ra khí H2.
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 (loãng) → FeSO4 + H2
b). Kim loại phản ứng với nước
- Trong nước nguyên chất (pH = 7):
Kim loại có có thể phản ứng với nước tạo thành base và khí H2.
- Ví dụ: nên Na phản ứng được với nước tạo thành base và khí H2. Phương trình hoá học:
2Na + 2H2O → 2NaOH + H2
c). Kim loại phản ứng với dung dịch muối
- Kim loại có thế điện cực chuẩn nhỏ hơn có khả năng khử được ion kim loại có thế điện cực chuẩn lớn hơn trong dung dịch muối ở điều kiện chuẩn.
- Ví dụ: Cho mẩu Zn vào dung dịch muối CuSO4 1M.
Do nên:
Zn + CuSO4 → ZnSO4 + Cu
(199k) Xem Khóa học Hóa 12 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Chân trời sáng tạo hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 12 Chân trời sáng tạo
- Giải SBT Hóa học 12 Chân trời sáng tạo
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST

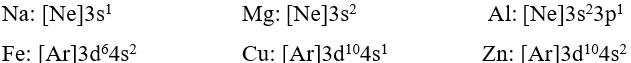




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

