Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch (Hóa 12 Chân trời sáng tạo Bài 20)
Với tóm tắt lý thuyết Hóa 12 Bài 20: Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch (Hóa 12 Chân trời sáng tạo Bài 20)
(199k) Xem Khóa học Hóa 12 CTST
I. THÀNH PHẦN VÀ DẠNG HÌNH HỌC CỦA PHỨC CHẤT
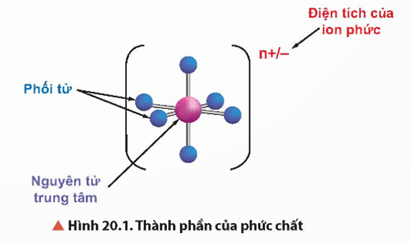
1. Thành phần của phức chất
- Trong phức chất có nguyên tử trung tâm (còn gọi là nhân trung tâm) và phối tử.
- Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho-nhận, trong đó phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
- Ví dụ:
+ Phức chất [Cr(NH3)6]3+ có nguyên tử trung tâm là Cr3+ và phối tử là NH3;
+ Phức chất [CrCl6]3- có nguyên tử trung tâm là Cr3+ và phối tử là ion Cl-;
+ Phức chất [PtCl2(NH3)2] có nguyên tử trung tâm là Pt2+, phối tử là NH3 và ion Cl-.
- Chú ý:
+ Nguyên tử trung tâm liên kết với các phối tử tạo thành cầu nội của phức chất thường được biểu diễn trong dấu [ ] và quyết định tính chất của phức chất.
+ Ngoài cầu nội phức chất thường có cầu ngoại (nhằm trung hòa điện tích với cầu nội).
Tuy nhiên cũng có một số phức chất chỉ chứa cầu nội như [Cr(NH3)6][CrCl6] hoặc [PtCl2(NH3)2].
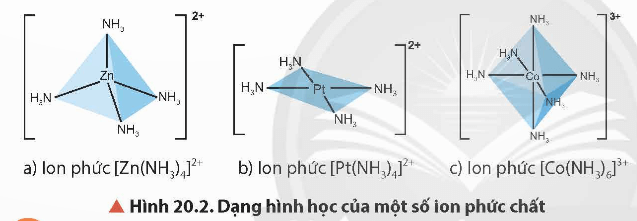
2. Dạng hình học
Các dạng hình học phổ biến của phức chất là tứ diện, vuông phẳng và bát diện.
II. SỰ HÌNH THÀNH PHỨC CHẤT TRONG DUNG DỊCH
1. Sự tạo thành phức chất aqua trong dung dịch
- Chất điện li khi tan vào nước sẽ phân li thành các ion. Các ion không tồn tại độc lập, chúng ở dạng các tiểu phân được bao quanh bởi các phân tử nước. Trong dung dịch, cation kim loại tồn tại dưới dạng phức chất aqua, các phân tử nước là phối tử.
- Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. Chúng thường có dạng [M(H2O)6]n+ như [Cu(H2O)6]2+, [Co(H2O)6]2+, [Cr(H2O)6]3+.
2. Một số dấu hiệu tạo ra phức chất trong dung dịch
- Dựa vào các dấu hiệu như màu sắc bị thay đổi, sự xuất hiện kết tủa, kết tủa bị hòa tan,…người ta có thể dự đoán phức chất trong dung dịch tạo thành.
- Ví dụ:
+ Khi hòa tan CuSO4 vào nước tạo thành phức chất aqua [Cu(H2O)6]2+ có màu xanh.
+ Khi nhỏ thêm vài giọt dung dịch kiềm sẽ tạo thành kết tủa xanh nhạt Cu(OH)2.
+ Khi có đến dư dung dịch ammonia vào kết tủa, kết tủa tan tạo thành dung dịch màu xanh lam chứa ion phức [Cu(NH3)4(H2O)2]2+ thường viết là [Cu(NH3)6]2+.
3. Phản ứng thay thế phối tử của phức chất trong dung dịch
Trong dung dịch có thể xảy ra phản ứng thay thế phối tử của phức chất.
Ví dụ:
[Cr(H2O)6]3+(aq) + 3OH-(aq)→ [Cr(H2O)3(OH)3]↓(s) + 3H2O(l)
[Cu(H2O)6]2+ + 4Cl- → [CuCl4]2- + 6H2O
III. THÍ NGHIỆM TẠO THÀNH MỘT SỐ PHỨC CHẤT TRONG DUNG DỊCH
Thí nghiệm 1: Thí nghiệm tạo thành cation [Cu(NH3)4]2+
Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Hóa chất: dung dịch copper(II) sulfate 0,5 M; dung dịch ammmonia 8%.
Cách tiến hành - hiện tượng – giải thích:
Cách tiến hành |
Hiện tượng |
Giải thích, phương trình hoá học |
Cho vào ống nghiệm khoảng 1 mL dung dịch CuSO4. Nhỏ từ từ từng giọt dung dịch ammonia vào ống nghiệm, quan sát hiện tượng. |
Thấy xuất hiện kết tủa màu xanh nhạt. |
Khi nhỏ thêm vài giọt dung dịch NH3 sẽ sinh ra kết tủa Cu(OH)2 màu xanh nhạt. CuSO4 + 2NH3 + 2H2O → Cu(OH)2+ (NH4)2SO4 |
Tiếp tục nhỏ thêm dung dịch ammonia và lắc ống nghiệm cho đến khi tạo thành dung dịch trong suốt. |
Kết tủa tan, tạo thành dung dịch màu xanh lam. |
Ở quá trình này, kết tủa tan tạo thành phức chất [Cu(NH3)4(H2O)2]2+ (hay viết gọn [Cu(NH3)4]2+ ) đã được hình thành. Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH– |
Thí nghiệm 2: Phản ứng tạo thành anion [CuCl4]2-
Dụng cụ: ống nghiệm, ống hút nhỏ giọt.
Hóa chất: dung dịch copper (II) sufate 0,5 M; dung dịch Hydrochloric acid đặc.
Tiến hành:
Cho vào ống nghiệm khoảng 0,5 ml dung dịch CuSO4. Thêm dần vào ống nghiệm khoảng 2 ml dung dịch HCl đặc, lắc ống nghiệm, quan sát hiện tượng.
Hiện tượng:Dung dịch chuyển từ màu xanh sang xanh lá, cuối cùng là màu vàng.
Phương trình hoá học: CuSO4 + 4HCl → H2[CuCl4] + H2SO4
IV. MỘT SỐ ỨNG DỤNG CỦA PHỨC CHẤT
Phức chất có rất nhiều ứng dụng trong các lĩnh vực như y học, dược học, hóa học,…
- Phức chất có ý nghĩa to lớn trong ngành y học và dược học. Nhiều dẫn xuất có hoạt tính sinh học trên cơ thể người là phức chất của các kim loại như Cu, Zn, Co, Pt, Au,…. Đây là cơ sở cho việc sản xuất thuốc chữa bệnh.
- Một số loại enzyme có thành phần phức chất của copper, vitamin B12 có vai trò quan trọng đối với cơ thể người là phức chất của cobalt. Nhiều phức chất được ứng dụng trong hóa học phân tích để định lượng các kim loại.
- Trong công nghiệp có nhiều phản ứng cần chất xúc tác là phức chất như phức chất của platium, palladium,…
(199k) Xem Khóa học Hóa 12 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Chân trời sáng tạo hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 12 Chân trời sáng tạo
- Giải SBT Hóa học 12 Chân trời sáng tạo
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

